Hvordan er faste stoffer væsker og gaspartikler forskellige?
Faststoffer:
- Partikler i faste stoffer er tæt pakket og holdt i faste positioner af stærke intermolekylære kræfter, såsom kovalente bindinger, ionbindinger eller metalliske bindinger.
- Partiklerne vibrerer omkring deres faste positioner, men har ikke nok energi til at bevæge sig frit rundt.
- Faste stoffer har en bestemt form og volumen, og de modstår enhver ændring i form eller volumen.
Væsker:
- Partiklerne i væsker holdes stadig af intermolekylære kræfter, men disse kræfter er svagere end i faste stoffer.
- Partikler i væsker er mere løst pakket og har mere kinetisk energi, så de kan bevæge sig mere frit.
- Væsker flyder og tager form af deres beholder, men de har et bestemt volumen.
- Volumenet af en væske kan til en vis grad komprimeres, men det er meget sværere at komprimere end volumenet af en gas.
Gasser:
- Partiklerne i gasser er meget langt fra hinanden, og de intermolekylære kræfter mellem dem er meget svage.
- Gaspartikler har høj kinetisk energi og bevæger sig meget hurtigt i en tilfældig og hurtig bevægelse.
- Gasser har ingen bestemt form eller volumen og udvider sig til at fylde hele den beholder, de optager.
- Gasser komprimeres let og kan udvide sig eller trække sig betydeligt sammen med ændringer i temperatur og tryk.
Sammenfattende har faste stoffer faste partikelpositioner, væsker har mobile partikler, men et fast volumen, og gasser har frit bevægelige partikler og ingen fast form eller volumen. Forskellene i de intermolekylære kræfter, partikelarrangementet og den kinetiske energi er årsag til de unikke egenskaber for hver stoftilstand.
Sidste artikelTætpakket arrangement af partikler, der tager form af deres beholder?
Næste artikelHvilken gift er effektiv?
 Varme artikler
Varme artikler
-
 Justering af nøjagtige forhold mellem to metaller i en katalysator kan muliggøre nye retninger ind…Michael Janik (til venstre), professor i kemiteknik i Penn State, og Robert Rioux, professor i kemiteknik fra Penn State, Friedrich G. Helfferich, udgav et Nature Chemistry-papir, hvori de testede eff
Justering af nøjagtige forhold mellem to metaller i en katalysator kan muliggøre nye retninger ind…Michael Janik (til venstre), professor i kemiteknik i Penn State, og Robert Rioux, professor i kemiteknik fra Penn State, Friedrich G. Helfferich, udgav et Nature Chemistry-papir, hvori de testede eff -
 Samarbejdsforskning kortlægger kursen til hundredvis af nye nitriderForskerne var i stand til at kortlægge, hvor nye nitrider kunne findes. Kredit:Josh Bauer/NREL Andriy Zakutayev ved, at oddsene for, at en videnskabsmand snubler over et nyt nitridmineral, er omtr
Samarbejdsforskning kortlægger kursen til hundredvis af nye nitriderForskerne var i stand til at kortlægge, hvor nye nitrider kunne findes. Kredit:Josh Bauer/NREL Andriy Zakutayev ved, at oddsene for, at en videnskabsmand snubler over et nyt nitridmineral, er omtr -
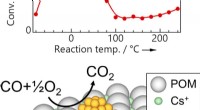 Ultraeffektiv fjernelse af kulilte ved hjælp af guld nanopartikler på en molekylær støtteNy katalysator bestående af guldnanopartikler understøttet på et Keggin-type polyoxometalat (POM) med et cæsiumsalt. Strukturen viste høj aktivitet og stabilitet for CO-oxidation; spormængder af vand
Ultraeffektiv fjernelse af kulilte ved hjælp af guld nanopartikler på en molekylær støtteNy katalysator bestående af guldnanopartikler understøttet på et Keggin-type polyoxometalat (POM) med et cæsiumsalt. Strukturen viste høj aktivitet og stabilitet for CO-oxidation; spormængder af vand -
 Højstyrke pultruderede termoplastiske kompositter lavet af nyt råmaterialeDet venstre foto viser fremstillingen af termoplastisk fladt laminat på en pultruderingsmaskine:Strimler af kildemateriale tilføres fra venstre, med kompositprofilerne trukket ud til højre. Det ande
Højstyrke pultruderede termoplastiske kompositter lavet af nyt råmaterialeDet venstre foto viser fremstillingen af termoplastisk fladt laminat på en pultruderingsmaskine:Strimler af kildemateriale tilføres fra venstre, med kompositprofilerne trukket ud til højre. Det ande
- Nye beviser for elektroner med dobbelt natur fundet i en kvantespinvæske
- Med Twitter, Budbringerens race betyder noget, siger undersøgelse
- Hvordan den kemiske industri kan opfylde klimamålene
- På trods af god fremgang, 100% lavemissionsenergi er stadig langt væk for Storbritannien
- De fleste virksomheder forsømte at inkludere pandemi i årlige risikovurderinger på trods af advar…
- Fangst insekter efter farve:Fungerer det i Montana?


