Hvad er pH-værdien af en 0,0001M vandopløsning salpetersyre?
1. Skriv den afbalancerede kemiske ligning for dissociationen af salpetersyre i vand:
HNO3 + H2O → H3O+ + NO3-
2. Opstil en ICE-tabel til at repræsentere startkoncentrationerne, ændringer i koncentrationer og ligevægtskoncentrationer af arterne i opløsningen:
| | HNO3 | H3O+ | NO3- |
|---|---|---|---|
| Indledende | 0,0001 mio. | 0M | 0M |
| Skift | -x | +x | +x |
| Ligevægt | (0,0001-x)M | xM | xM |
3. Erstat ligevægtskoncentrationerne med udtrykket for syredissociationskonstanten (Ka) for salpetersyre:
Ka =[H3O+][NO3-]/[HNO3]
Ka =x^2/(0,0001-x)
4. Da Ka for salpetersyre er meget stor (2,0 x 10^6), kan vi antage, at x er meget mindre end 0,0001 og simplificere udtrykket:
Ka ≈ x^2/0,0001
x^2 ≈ 2,0 x 10^(-8)
x ≈ 1,4 x 10^(-4)
5. Beregn opløsningens pH ved hjælp af formlen:
pH =-log[H3O+]
pH =-log(1,4 x 10^(-4))
pH ≈ 3,85
Derfor er pH-værdien af en 0,0001M vandopløsning af salpetersyre ca. 3,85.
Sidste artikelHvad binder elektronerne i en kovalent binding?
Næste artikelHar et amorft fast stof et sandt smeltepunkt?
 Varme artikler
Varme artikler
-
 Ny katalysator bevist effektiv i elektrosyntese af ammoniakSkematisk illustration af den syntetiske proces af Mo-SAs/AC. Kredit:GENG Jing I nyere forskning, forskere ledet af prof. Zhang Haimin fra Institute of Solid State Physics ved Hefei Institutes of
Ny katalysator bevist effektiv i elektrosyntese af ammoniakSkematisk illustration af den syntetiske proces af Mo-SAs/AC. Kredit:GENG Jing I nyere forskning, forskere ledet af prof. Zhang Haimin fra Institute of Solid State Physics ved Hefei Institutes of -
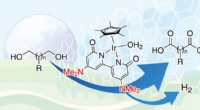 Team syntetiserer samtidigt dicarboxylsyrer og hydrogen fra diolerVed anvendelse af en iridiumkatalysator bundet til en bipyridonatligand, forskere var i stand til at syntetisere dicarboxylsyrer fra vandige dioler, med den ekstra fordel at generere brint som et bipr
Team syntetiserer samtidigt dicarboxylsyrer og hydrogen fra diolerVed anvendelse af en iridiumkatalysator bundet til en bipyridonatligand, forskere var i stand til at syntetisere dicarboxylsyrer fra vandige dioler, med den ekstra fordel at generere brint som et bipr -
 Maskinlæringsforskning, der låser op for molekylære bure energibesparende potentialeKredit:Oregon State University Nanoserede bure kan spille en stor rolle i at reducere energiforbruget i videnskab og industri, og maskinlæringsforskning ved Oregon State University har til formål
Maskinlæringsforskning, der låser op for molekylære bure energibesparende potentialeKredit:Oregon State University Nanoserede bure kan spille en stor rolle i at reducere energiforbruget i videnskab og industri, og maskinlæringsforskning ved Oregon State University har til formål -
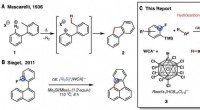 Funktionalisering af uaktiverede alkaner ved hjælp af reaktioner baseret på katalysatorer fremstil…Reaktioner, der involverer formodede phenylkationer. (A) Mascarellis reaktion (12). (B) Siegels intramolekylære Friedel-Crafts reaktion af arylfluorider (15). (C) Vores dobbelte C–F/C–H-funktionaliser
Funktionalisering af uaktiverede alkaner ved hjælp af reaktioner baseret på katalysatorer fremstil…Reaktioner, der involverer formodede phenylkationer. (A) Mascarellis reaktion (12). (B) Siegels intramolekylære Friedel-Crafts reaktion af arylfluorider (15). (C) Vores dobbelte C–F/C–H-funktionaliser
- Lydforstærkerens historie
- Forskere finder en ny måde at måle flyvende baseballs på
- Forsker øger effektiviteten af en type solcelle ved at inkorporere ioniske salte
- Det er matematisk umuligt at slå aldring, siger videnskabsmænd
- Game of Thrones:til HBO, piratkopiering er bedre end en Emmy, da det bekæmper Netflix
- Hvad er brændværdien af naphthalen?


