Hvad binder elektronerne i en kovalent binding?
Delokalisering af elektroner er det, der giver kovalente bindinger deres styrke. Jo mere delokaliserede elektronerne er, jo stærkere er bindingen. Dette skyldes, at delokalisering af elektroner øger overlapningen mellem de atomare orbitaler af atomerne involveret i bindingen. Jo større overlapning, jo stærkere bånd.
Kovalente bindinger er den stærkeste type kemisk binding. De findes i mange forskellige typer molekyler, herunder molekyler af vand, kuldioxid og metan.
 Varme artikler
Varme artikler
-
 Forskere leder bakterier med udvidet genetisk kode til at udvikle ekstrem varmetoleranceEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH I de seneste år, forskere har konstrueret bakterier med udvidede genetiske koder, der producerer proteiner fremstillet af et breder
Forskere leder bakterier med udvidet genetisk kode til at udvikle ekstrem varmetoleranceEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH I de seneste år, forskere har konstrueret bakterier med udvidede genetiske koder, der producerer proteiner fremstillet af et breder -
 Strontiumtitanats nye egenskaber er vigtige for elektronikforskningEPR-spektre for de (001)-orienterede enkeltkrystalprøver med form som en stang og en plade af STO:Fe3+ ved T =300 K (a) og af en plade af STO:Mn4+ ved T =150 K (b) . Orienteringerne af prøverne i forh
Strontiumtitanats nye egenskaber er vigtige for elektronikforskningEPR-spektre for de (001)-orienterede enkeltkrystalprøver med form som en stang og en plade af STO:Fe3+ ved T =300 K (a) og af en plade af STO:Mn4+ ved T =150 K (b) . Orienteringerne af prøverne i forh -
 Kantarelsvampe som smagsforstærkerDr. Verena Mittermeier fra formanden for fødevarekemi og molekylær sensorisk videnskab og Andreas Dunkel fra Leibniz-instituttet for fødevaresystembiologi foran deres institut. Kredit:Leibniz-LSB@TUM
Kantarelsvampe som smagsforstærkerDr. Verena Mittermeier fra formanden for fødevarekemi og molekylær sensorisk videnskab og Andreas Dunkel fra Leibniz-instituttet for fødevaresystembiologi foran deres institut. Kredit:Leibniz-LSB@TUM -
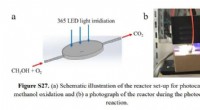 Effektivitet i fotokatalyse viste sig at være stedfølsomSupplerende billede af testapparatet. Kredit:https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202014037 Prof. Huang Weixin og Zhang Qun fra University of Science and Technology of China (USTC)
Effektivitet i fotokatalyse viste sig at være stedfølsomSupplerende billede af testapparatet. Kredit:https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202014037 Prof. Huang Weixin og Zhang Qun fra University of Science and Technology of China (USTC)
- Faith 2.0:Pilgrimme henvender sig til teknologi for at booste hajj
- Jordens stabile temperatur tidligere tyder på, at andre planeter også kan opretholde liv
- Hvordan klimaændringer fik verdens første imperium til at kollapse
- Hvordan Solar Sail Technology virker
- Hvordan indesluttede protoner migrerer
- Hvad er reduceret og oxideret i fotosyntese?


