Hvorfor lægge salt på en vej, når temperaturen når op på 0 grader Celsius?
Når salt opløses i vand, nedbrydes det i dets bestanddele - natrium (Na+) og chlorid (Cl-). Disse ioner forstyrrer frysningsprocessen af vand. Normalt binder vandmolekyler sig sammen og danner krystaller ved 0 grader Celsius. Tilstedeværelsen af disse ioner forstyrrer imidlertid bindingsprocessen, hvilket kræver en lavere temperatur for vandet at fryse. Dette sænkede frysepunkt sikrer, at isen og sneen på vejen smelter effektivt.
Eutetisk frysepunkt :Kombinationen af salt og vand skaber en opløsning med et lavere eutektisk frysepunkt sammenlignet med rent vand. Det eutektiske punkt refererer til den temperatur, ved hvilken en blanding vil smelte fuldstændigt, selv i nærværelse af overskydende faste stoffer. For saltvandssystemet er det eutektiske punkt cirka -21 grader Celsius, betydeligt lavere end frysepunktet for rent vand. Dette gør det muligt for opløsningen at forblive flydende og effektiv selv under ekstremt kolde forhold.
Det er vigtigt at bemærke, at brug af salt til afisning kan have potentielle ulemper. Det kan korrodere metaller og beskadige planter langs vejkanten. I nogle tilfælde kan overskydende salt også danne en saltlage, der siver ned i grundvandet eller nærliggende vandområder, hvilket påvirker det omgivende økosystem. Derfor skal anvendelse af alternative foranstaltninger eller saltalternativer nøje overvejes for at balancere effektiviteten af afisning med miljøhensyn.
Sidste artikelHvorfor transporteres svovlsyre i tankvogne?
Næste artikelHvad binder elektronerne i en kovalent binding?
 Varme artikler
Varme artikler
-
 Molekylært tynd grænseflade mellem polymerer til effektiv kuldioxidfangermembranFritstående og mekanisk stærke nanomembraner sammensat af to polymere lag viste overlegen kuldioxidadskillelse fra nitrogen. Som afsløret af undersøgelsen spillede overfladen af den sammensatte memb
Molekylært tynd grænseflade mellem polymerer til effektiv kuldioxidfangermembranFritstående og mekanisk stærke nanomembraner sammensat af to polymere lag viste overlegen kuldioxidadskillelse fra nitrogen. Som afsløret af undersøgelsen spillede overfladen af den sammensatte memb -
 Forskere låser op for kræftfremkaldende mekanisme af E. coli-toksin med syntetisk biologi tilgangProf. Qian Peiyuan (til højre) og en forsker fra hans team, LI Zhongrui, dyrkning af bakterier med maskinen til højre. Kredit:Hong Kong University of Science and Technology Et tværfagligt team af
Forskere låser op for kræftfremkaldende mekanisme af E. coli-toksin med syntetisk biologi tilgangProf. Qian Peiyuan (til højre) og en forsker fra hans team, LI Zhongrui, dyrkning af bakterier med maskinen til højre. Kredit:Hong Kong University of Science and Technology Et tværfagligt team af -
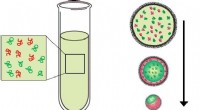 Cellestørrelse regulerer molekylær adskillelseVandig opløsning af to polymerer (rød og grøn) i et reagensglas og i kunstige celler af forskellig størrelse. I reagensglasset blandes opløsningen homogent, men i den lille kunstige celle skilles oplø
Cellestørrelse regulerer molekylær adskillelseVandig opløsning af to polymerer (rød og grøn) i et reagensglas og i kunstige celler af forskellig størrelse. I reagensglasset blandes opløsningen homogent, men i den lille kunstige celle skilles oplø -
 Sollys-drevet fotokatalytisk vandopdeling til brintproduktion i stor skalaPanoramaudsigt over brintproduktionens fotokatalytiske panelreaktionssystem. Kredit:Tilpasset fra Nishiyama, H., Yamada, T., Nakabayashi, M. et al. Storstilet solbrintproduktion gennem vandopdelin
Sollys-drevet fotokatalytisk vandopdeling til brintproduktion i stor skalaPanoramaudsigt over brintproduktionens fotokatalytiske panelreaktionssystem. Kredit:Tilpasset fra Nishiyama, H., Yamada, T., Nakabayashi, M. et al. Storstilet solbrintproduktion gennem vandopdelin
- Forskere identificerer funktioner, der kan gøre nogen til en virus-superspreder
- Torii får botnet-watchere til at kigge to gange og tænke meget over IoT-sikkerhed
- Smeltende iskapper kan forårsage klimakaos ifølge nye modeller
- Selvsamlende nanopartikler kunne forbedre MR-scanning til kræftdiagnose
- Forskere opfinder hurtigere, billigere strategi til design af infrarødt emitterende materialer
- Hvorfor eksploderer Supernovaen ikke?


