Ekspanderer gasser for at fylde den plads, der er til rådighed?
Gaspartikler er i konstant bevægelse og bevæger sig frit i alle retninger. Når en gas indføres i en beholder, vil gaspartiklerne kollidere med beholderens vægge. Mens de gør det, udøver de en kraft på væggene. Denne kraft er det, vi oplever som pres.
En gass tryk er direkte proportional med dens temperatur og omvendt proportional med dens volumen. Det betyder, at når temperaturen på en gas stiger, vil dens tryk også stige. Omvendt, når volumenet af en gas stiger, vil dens tryk falde.
Når en gas indføres i en tom beholder, vil gaspartiklerne spredes ud og fylde hele beholderen. Dette skyldes, at der ikke er nogen kraft, der modsætter sig udvidelsen af gassen. Gaspartiklerne vil fortsætte med at udvide sig, indtil de når en ligevægt, hvor trykket af gassen er lig med trykket i det omgivende miljø.
Udvidelsen af gasser er vigtig i mange applikationer, såsom:
* Driften af forbrændingsmotorer
* Designet af luftballoner
* Funktionen af køleskabe og klimaanlæg
* Produktion af mad og drikkevarer
 Varme artikler
Varme artikler
-
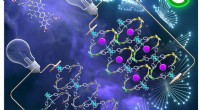 Novel MOF er potentiel næste generations halvlederSourav Sahas metal-organiske rammeforskning blev vist på forsiden af ACS Applied Materials &Interfaces den 18. marts, 2020. Kredit:Høflighed Sourav Saha Metal-organiske rammer (MOFer) er nye mul
Novel MOF er potentiel næste generations halvlederSourav Sahas metal-organiske rammeforskning blev vist på forsiden af ACS Applied Materials &Interfaces den 18. marts, 2020. Kredit:Høflighed Sourav Saha Metal-organiske rammer (MOFer) er nye mul -
 Gennembrud i sur vandelektrolyse via rutheniumbaserede katalysatorerIltudviklingsreaktion (OER) og oxygenreduktionsreaktion (ORR) kan betragtes som to trofæer inden for effektiv udnyttelse af brintenergi. Imidlertid, i sur OER, et stort anvendt potentiale var påkrævet
Gennembrud i sur vandelektrolyse via rutheniumbaserede katalysatorerIltudviklingsreaktion (OER) og oxygenreduktionsreaktion (ORR) kan betragtes som to trofæer inden for effektiv udnyttelse af brintenergi. Imidlertid, i sur OER, et stort anvendt potentiale var påkrævet -
 Facil metode foreslået til mikrofabrikation på ikke-plane substraterFleksibel hulmaske muliggjorde mønsterdannelse af mikroskala hydrofil/hydrofob grænseflade på forskellige substrater. Kredit:YAN Shiqiang De fleste mikrofabrikationsteknologier er fokuseret på den
Facil metode foreslået til mikrofabrikation på ikke-plane substraterFleksibel hulmaske muliggjorde mønsterdannelse af mikroskala hydrofil/hydrofob grænseflade på forskellige substrater. Kredit:YAN Shiqiang De fleste mikrofabrikationsteknologier er fokuseret på den -
 Forskere afslører skjult katalytisk overflade af Ni-Au kerneskal i kuldioxidhydrogenering1a) In situ TEM -billedserier; fig. Ib) katalytisk ydeevne; 1c) skematisk illustration Kredit:LIU Wei Årevis, kerne-skal strukturerede partikler er blevet anerkendt som veldesignede katalysatorer,
Forskere afslører skjult katalytisk overflade af Ni-Au kerneskal i kuldioxidhydrogenering1a) In situ TEM -billedserier; fig. Ib) katalytisk ydeevne; 1c) skematisk illustration Kredit:LIU Wei Årevis, kerne-skal strukturerede partikler er blevet anerkendt som veldesignede katalysatorer,
- Niveauoverskridende fjernelser:Et casestudie om, hvorfor store projekter også skal være investerin…
- Super-adsorberende MOF fanger dobbelt så meget i vand
- Forskning undersøger, hvordan beslutninger om embryonal udvikling styres af flere veje samtidigt
- Kan sult udryddes inden 2030?
- Træer sætter sjetteklasseelever op til succes
- Det første nogensinde foto af et sort hul er et kæmpe tilbud


