Hvad kan væske og gas, som faststof ikke kan?
Væsker har et fast volumen, men ingen bestemt form, mens gasser hverken har et fast volumen eller en bestemt form. Både væsker og gasser kan nemt strømme forbi faste genstande og gennem små åbninger. I modsætning hertil har faste stoffer en stiv struktur og en fast form, og de kan ikke flyde eller deformeres let.
Væsker og gasser kan også gennemgå diffusion, som er bevægelsen af partikler fra et område med højere koncentration til et område med lavere koncentration. Denne proces forekommer naturligt i både væsker og gasser, så de kan blandes og spredes jævnt. Diffusion er meget langsommere i faste stoffer, fordi partiklerne er tættere pakket og har mindre frihed til at bevæge sig.
Væsker og gasser udviser også overfladespænding, som er en væskes eller gass tendens til at minimere dens overfladeareal. Denne effekt kan observeres i dannelsen af sæbebobler og vanddråber, hvor overfladen af væsken eller gassen danner en tynd, elastisk membran for at minimere dens areal. Overfladespændingen er relativt svag i faste stoffer og spiller ikke en væsentlig rolle i deres adfærd.
Flydende, diffusions- og overfladespændingsegenskaber af væsker og gasser adskiller dem fra faste stoffer og giver dem unikke egenskaber, der er afgørende for adskillige naturlige og industrielle processer.
Sidste artikelHvorfor kaldes faste stoffer ikke væsker?
Næste artikelEr tyngdekraften en fast eller flydende gas noget andet?
 Varme artikler
Varme artikler
-
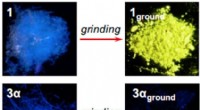 Guldforbindelse skifter fra en synlig fluorescens til at udsende infrarød, når den jordes9-anthryl guld(I) isocyanid (3α) bliver usynligt og udsender infrarødt efter det er malet, mens phenylguld(I) isocyanid (1) bliver gult. Kredit:Seki T. et al., Journal of the American Chemical Societ
Guldforbindelse skifter fra en synlig fluorescens til at udsende infrarød, når den jordes9-anthryl guld(I) isocyanid (3α) bliver usynligt og udsender infrarødt efter det er malet, mens phenylguld(I) isocyanid (1) bliver gult. Kredit:Seki T. et al., Journal of the American Chemical Societ -
 Forskere identificerer et molekyle, der kunne have hjulpet celler med at overleve - og trives - på …Protoceller ville have været forfædre til celler i dag, hvis du vil, ” siger Ramanarayanan Krishnamurthy, PhD, en lektor i kemi ved Scripps Research. De havde ikke den fulde funktionalitet af moderne
Forskere identificerer et molekyle, der kunne have hjulpet celler med at overleve - og trives - på …Protoceller ville have været forfædre til celler i dag, hvis du vil, ” siger Ramanarayanan Krishnamurthy, PhD, en lektor i kemi ved Scripps Research. De havde ikke den fulde funktionalitet af moderne -
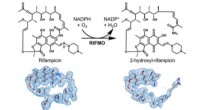 Forskere opdager ny mekanisme for antibiotikaresistens ved spedalskhed og tuberkuloseDenne figur viser de strukturelle beviser for, hvordan rifampicin monooxgenase (RIFMO) inaktiverer rifampicin, omdannelse af cyklisk rifampicin til lineær form 2-hydroxyl-rifampicin. Kredit:Pablo Sobr
Forskere opdager ny mekanisme for antibiotikaresistens ved spedalskhed og tuberkuloseDenne figur viser de strukturelle beviser for, hvordan rifampicin monooxgenase (RIFMO) inaktiverer rifampicin, omdannelse af cyklisk rifampicin til lineær form 2-hydroxyl-rifampicin. Kredit:Pablo Sobr -
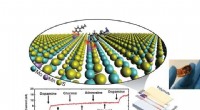 Meget følsom dopamindetektor bruger 2-D materialerSkematisk af en meget selektiv dopamindetektor ved brug af todimensionelt materiale. Kredit:Derrick Butler, Penn State En superfølsom dopamindetektor kan hjælpe med tidlig diagnosticering af flere
Meget følsom dopamindetektor bruger 2-D materialerSkematisk af en meget selektiv dopamindetektor ved brug af todimensionelt materiale. Kredit:Derrick Butler, Penn State En superfølsom dopamindetektor kan hjælpe med tidlig diagnosticering af flere
- Lateral krystalvækst ved hjælp af oxid nanosheets som frøkrystaller
- Hvordan reagerer technetium på andre grundstoffer?
- Zink-ion hybridkondensatorer med ideelle anioner i elektrolytten viser ekstra lang ydeevne
- Maskinlæring bruges til at forudsige jordskælv i laboratoriemiljøer
- Hvordan er fossile brændstoffer ekstraheret fra jorden?
- Flere investeringer er nødvendige for klimavidenskab i Afrika for at forbedre vejrudsigten og redde…


