Hvorfor kaldes faste stoffer ikke væsker?
I faste stoffer er partiklerne tæt pakket og holdt sammen af stærke intermolekylære kræfter, såsom kovalente bindinger eller ionbindinger. Disse kræfter skaber en stiv struktur, der forhindrer partiklerne i at bevæge sig frit forbi hinanden. Som et resultat bevarer faste stoffer en bestemt form og volumen og flyder ikke.
I modsætning hertil er væsker sammensat af partikler, der er relativt langt fra hinanden og svagt bundet af intermolekylære kræfter såsom van der Waals-kræfter eller hydrogenbindinger. Disse kræfter tillader partiklerne at bevæge sig frit og glide forbi hinanden, hvilket gør det muligt for væsker at tage form af deres beholder og udvise flydende.
Derfor adskiller faste stoffers manglende evne til at flyde på grund af deres stærke intermolekylære kræfter dem fra væsker. Faste stoffer bevarer en fast form og volumen, mens væsker tilpasser sig formen på deres beholder og flyder let.
 Varme artikler
Varme artikler
-
 At se nærmere på genetiske skift i kræftEn krystalstruktur af en del af menneskelig DPF2, et protein, der styrer en genetisk switch, der fortæller blodstamceller, hvornår de skal blive røde og hvide blodlegemer. Orange og gule områder illus
At se nærmere på genetiske skift i kræftEn krystalstruktur af en del af menneskelig DPF2, et protein, der styrer en genetisk switch, der fortæller blodstamceller, hvornår de skal blive røde og hvide blodlegemer. Orange og gule områder illus -
 Lab-on-a-chip driver søgning efter nye lægemidler for at forhindre blodpropperDen biokompatible enhed indeholder de komplekse funktioner i et patologilaboratorium, i miniature. Kredit:RMIT University Et lille laboratorium på størrelse med et frimærke kan være den næste stor
Lab-on-a-chip driver søgning efter nye lægemidler for at forhindre blodpropperDen biokompatible enhed indeholder de komplekse funktioner i et patologilaboratorium, i miniature. Kredit:RMIT University Et lille laboratorium på størrelse med et frimærke kan være den næste stor -
 Forskere forvandler giftigt pesticid til behandling mod antibiotikaresistente bakterierKredit:Pixabay/CC0 Public Domain N-Aryl-C-nitroazoler er en vigtig klasse af heterocykliske forbindelser. De bruges som pesticider og fungicider. Imidlertid, disse stoffer kan være giftige for men
Forskere forvandler giftigt pesticid til behandling mod antibiotikaresistente bakterierKredit:Pixabay/CC0 Public Domain N-Aryl-C-nitroazoler er en vigtig klasse af heterocykliske forbindelser. De bruges som pesticider og fungicider. Imidlertid, disse stoffer kan være giftige for men -
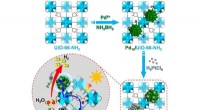 Enkeltatomlegering:Fremragende cokatalysator til fotokatalyseOverfladeladningstilstanden af co-katalysator spiller en vigtig rolle i fotokatalyse. Imidlertid, forordningen om overfladeladningstilstand for co-katalysatorer, især ved at ændre deres mikrostruktu
Enkeltatomlegering:Fremragende cokatalysator til fotokatalyseOverfladeladningstilstanden af co-katalysator spiller en vigtig rolle i fotokatalyse. Imidlertid, forordningen om overfladeladningstilstand for co-katalysatorer, især ved at ændre deres mikrostruktu
- Kvantestøddæmpere tillader perovskit at udvise superfluorescens ved stuetemperatur
- Lysforurening:Den mørke side af at holde lyset tændt
- Klimabeskyttelse:Dyb dekarbonisering i 2050 er i øjeblikket ikke sandsynlig
- Afdække, hvordan planter ser blåt lys
- Billede:Modulær eksperimentplatform på ISS
- Mitose er til kroppens celler som meiose til?


