Kombinerer atomer ved at dele elektroner?
Når to eller flere atomer nærmer sig hinanden, kan deres valenselektroner (elektroner i den yderste skal) interagere. Hvis atomerne er tæt nok på, kan valenselektronerne deles mellem kernerne, hvilket resulterer i en stærk tiltrækningskraft, der holder atomerne sammen.
I en kovalent binding bidrager hvert atom med en eller flere elektroner, der skal deles, hvilket skaber en stabil elektronkonfiguration for begge atomer. Disse delte elektroner er ikke længere udelukkende forbundet med et atom, men danner i stedet en "sky" af elektroner, der omgiver de bundne atomer.
Antallet af elektroner, der deles mellem atomer, bestemmer styrken og typen af kovalent binding. For eksempel i en enkelt kovalent binding deler to atomer et par elektroner, mens de i en dobbelt kovalent binding deler to par elektroner og så videre.
Overordnet set er deling af elektroner mellem atomer et afgørende koncept for at forstå kemisk binding og arrangementet af atomer for at danne molekyler og forbindelser med forskellige egenskaber og karakteristika.
 Varme artikler
Varme artikler
-
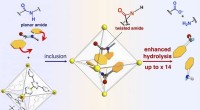 En molekylær trykkoger mører hårde stykker protein og hjælper med at bide afEt skema for reaktionshastighedsacceleration af amidhydrolyse ved inklusion i det selvsamlede molekylære bur. Kredit:NINS/IMS Proteiner består af aminosyrer forbundet med amidbindinger. Amidbindin
En molekylær trykkoger mører hårde stykker protein og hjælper med at bide afEt skema for reaktionshastighedsacceleration af amidhydrolyse ved inklusion i det selvsamlede molekylære bur. Kredit:NINS/IMS Proteiner består af aminosyrer forbundet med amidbindinger. Amidbindin -
 Ny polymer komposit til elektromagnetisk afskærmningRoterende kystradarovervågningsstation. Kredit:Janar Sinivali forskere fra NUST MISIS, South Ural State University og Joint Institute for Nuclear Research sammen med kolleger fra Egypten, Saudi -A
Ny polymer komposit til elektromagnetisk afskærmningRoterende kystradarovervågningsstation. Kredit:Janar Sinivali forskere fra NUST MISIS, South Ural State University og Joint Institute for Nuclear Research sammen med kolleger fra Egypten, Saudi -A -
 Forskere opdager en ny fase i blokcopolymererKunstnerens koncept, der skildrer blokpolymerer pakket sammen til dannelse, I dette tilfælde, en ny fase af diblok-copolymer. Kredit:Brian Long Alt stof består af en eller flere faser - områder af
Forskere opdager en ny fase i blokcopolymererKunstnerens koncept, der skildrer blokpolymerer pakket sammen til dannelse, I dette tilfælde, en ny fase af diblok-copolymer. Kredit:Brian Long Alt stof består af en eller flere faser - områder af -
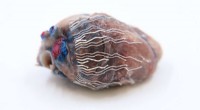 Tynd, strækbare biosensorer kan gøre operationen mere sikkerDe nye biosensorer giver mulighed for samtidig optagelse og billeddannelse af væv og organer under kirurgiske procedurer. På dette bilede, forskere fastgjorde biosensoren til hjertet af en gris, der b
Tynd, strækbare biosensorer kan gøre operationen mere sikkerDe nye biosensorer giver mulighed for samtidig optagelse og billeddannelse af væv og organer under kirurgiske procedurer. På dette bilede, forskere fastgjorde biosensoren til hjertet af en gris, der b
- Plastic Recycling Symbols and Meanings i USA
- Hvorfor alger kan være vores næste hemmelige våben til at bekæmpe plastikforurening
- Nemme opfindelser til videnskabsprojekter
- Giv den plasmabehandlingen:Stærk vedhæftning uden klæbemidler
- Hvem var Apollo 12-astronauterne?
- Problemer med parasitter? Bare migrér!


