Hvordan påvirker temperaturen gassen i en ballon?
Omvendt, når temperaturen falder, falder den gennemsnitlige kinetiske energi af gasmolekylerne, hvilket får dem til at bevæge sig langsommere og ramme ballonens vægge sjældnere og med mindre kraft. Dette fører til et fald i trykket inde i ballonen, hvilket får den til at skrumpe. I ekstreme tilfælde kan ballonen endda falde sammen.
Forholdet mellem temperatur og gastryk er kendt som Charles's lov, som siger, at trykket af en gas er direkte proportional med dens temperatur, forudsat at volumen og mængden af gas forbliver konstant. Denne lov kan udtrykkes matematisk som:
```
P =k * T
```
Hvor:
* P repræsenterer gassens tryk i atmosfærer (atm)
* k er en proportionalitetskonstant
* T repræsenterer gassens temperatur i Kelvin (K)
Ved at forstå, hvordan temperaturen påvirker gassen i en ballon, kan vi kontrollere dens størrelse og form til forskellige anvendelser, såsom vejrballoner, festballoner og medicinske balloner.
 Varme artikler
Varme artikler
-
 Verdens ældste ost fundet i egyptisk gravKredit:American Chemical Society Lagring forbedrer normalt smagen af ost, men det er ikke derfor, at en meget gammel ost, der blev opdaget i en egyptisk grav, gør opmærksom. I stedet, det menes
Verdens ældste ost fundet i egyptisk gravKredit:American Chemical Society Lagring forbedrer normalt smagen af ost, men det er ikke derfor, at en meget gammel ost, der blev opdaget i en egyptisk grav, gør opmærksom. I stedet, det menes -
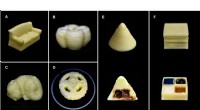 Forskere udvikler en enkel metode til 3-D-print af mælkeprodukterA - D:3D-printede mælkestrukturer af sofa, fæstning, hjul, og kløverblad, henholdsvis. E:3D-printet kegle indeholdende flydende chokoladesirup som internt fyld.F:3D-printet terning med fire rum indeho
Forskere udvikler en enkel metode til 3-D-print af mælkeprodukterA - D:3D-printede mælkestrukturer af sofa, fæstning, hjul, og kløverblad, henholdsvis. E:3D-printet kegle indeholdende flydende chokoladesirup som internt fyld.F:3D-printet terning med fire rum indeho -
 Forskere skaber lokkemaling, der lurer infrarøde kameraerBogstaverne C-A-L fremstår seje, selvom miljøet er varmt. UC Berkeley -ingeniører udvikler et lokkedue, der lader infrarøde kameraer til at opfatte en bestemt temperatur frem for objektets faktiske te
Forskere skaber lokkemaling, der lurer infrarøde kameraerBogstaverne C-A-L fremstår seje, selvom miljøet er varmt. UC Berkeley -ingeniører udvikler et lokkedue, der lader infrarøde kameraer til at opfatte en bestemt temperatur frem for objektets faktiske te -
 Ny trykteknik til fleksibel elektronik(A) Skematisk illustration af processen til tørtransfertrykning afhængigt af det atomare diffusionsniveau af materialet med en høj CTE. Processen er klassificeret i et lav-interdiffusionslag (Au) og (
Ny trykteknik til fleksibel elektronik(A) Skematisk illustration af processen til tørtransfertrykning afhængigt af det atomare diffusionsniveau af materialet med en høj CTE. Processen er klassificeret i et lav-interdiffusionslag (Au) og (
- IceCube-detektion af en højenergipartikel beviser 60-årig teori
- løfter, løfter:Facebooks historie med privatliv
- Molekylært stillads hjælper konstruktion på nanoskala
- Forskere skaber helelektrisk spintronik
- 3 internetsprogtendenser fra 2019, forklaret
- Astronomer undersøger de fysiske egenskaber af galaksen PGC 26218


