Hvad er formlen for ionforbindelse, der forventes at dannes mellem grundstofferne K og S?
Kalium (K) er i gruppe 1 i det periodiske system og har en tendens til at miste en valenselektron for at opnå en stabil elektronkonfiguration. Dette resulterer i dannelsen af en positivt ladet kaliumion (K+).
Svovl (S) er i gruppe 16 i det periodiske system og har tendens til at få to valenselektroner for at opnå en stabil elektronkonfiguration. Dette resulterer i dannelsen af en negativt ladet sulfidion (S2-).
For at danne en neutral forbindelse skal ionernes positive og negative ladninger balancere. I dette tilfælde vil en kaliumion (K+) med en +1 ladning kombineres med en sulfidion (S2-) med en -2 ladning.
Derfor er formlen for den ioniske forbindelse, der forventes at dannes mellem kalium og svovl, K2S, der repræsenterer et molekyle, der indeholder to kaliumioner og en sulfidion, hvilket resulterer i en neutral forbindelse.
Sidste artikelHvis et kloratom skulle tiltrække en elektron fra natrium ville det blive blankladet?
Næste artikelHvad er silikater lavet af?
 Varme artikler
Varme artikler
-
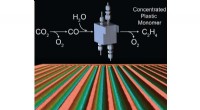 Effektive elektrokemiske celler til CO2-omdannelseDenne illustration er en kunstners gengivelse af elektrolyseprocessen, der bruges til at omdanne CO2 til koncentrerede kulstofprodukter. Kredit:Ripatti et al. Forskere ved Stanford University ha
Effektive elektrokemiske celler til CO2-omdannelseDenne illustration er en kunstners gengivelse af elektrolyseprocessen, der bruges til at omdanne CO2 til koncentrerede kulstofprodukter. Kredit:Ripatti et al. Forskere ved Stanford University ha -
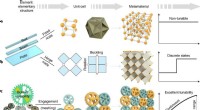 Gear-baserede mekaniske metamaterialer giver mulighed for oprettelse af konfigurerbare arkDesignkoncepter af mekaniske metamaterialer. a,b, klassisk paradigme:ikke-afstembart metamateriale (a) og typisk rekonfigurerbart metamateriale (b). c, Gear-baserede metamaterialer. Kredit:Nature Mate
Gear-baserede mekaniske metamaterialer giver mulighed for oprettelse af konfigurerbare arkDesignkoncepter af mekaniske metamaterialer. a,b, klassisk paradigme:ikke-afstembart metamateriale (a) og typisk rekonfigurerbart metamateriale (b). c, Gear-baserede metamaterialer. Kredit:Nature Mate -
 Jo langsommere de drejer, jo lysere lyser deKobberkompleksernes fotoluminescensevne øges, når deres molekylære struktur øges. Efterhånden som kobberkomplekser bliver større i strukturen (øger fra venstre mod højre), deres bevægelser bremses. De
Jo langsommere de drejer, jo lysere lyser deKobberkompleksernes fotoluminescensevne øges, når deres molekylære struktur øges. Efterhånden som kobberkomplekser bliver større i strukturen (øger fra venstre mod højre), deres bevægelser bremses. De -
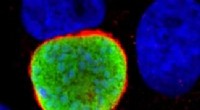 Malaria kaprer dine gener for at invadere din leverI de tidlige stadier af infektion, malariaparasitten (grøn) gemmer sig i en persons leverceller (blå), før den invaderer deres blod. Vist med rødt er et menneskeligt protein, som parasitten co-opterer
Malaria kaprer dine gener for at invadere din leverI de tidlige stadier af infektion, malariaparasitten (grøn) gemmer sig i en persons leverceller (blå), før den invaderer deres blod. Vist med rødt er et menneskeligt protein, som parasitten co-opterer
- Cassini afslører ny skulptur i Saturn-ringe
- Ny metode til at opdage mikroplastik under vores fødder
- Forskere finder ud af, hvorfor ultramarinblåt falmer
- Skaber kaos:Kratere og kollaps på Mars
- Ti gange flere hyperlysende galakser observeret, end stjerner kan producere
- Forskellen mellem elektrostatiske og magnetostatiske felter?


