Hvilket volumen nitrogen ved 215 C og 715 mmHg ville være nødvendigt for at reagere med 0,1 mol brint til at producere ammoniak?
Den afbalancerede kemiske ligning for reaktionen er:
$$N_2 + 3H_2 \højrepil 2NH_3$$
Ifølge ligningen reagerer 1 mol nitrogen med 3 mol brint. Derfor kræver 0,1 mol brint 1/3 mol nitrogen for at opnå fuldstændig reaktion.
Ved at bruge den ideelle gaslov, $$PV =nRT$$ hvor P er tryk, V er volumen, n er antallet af mol, R er den ideelle gaskonstant, og T er temperatur.
Vi kan omarrangere ligningen for at beregne volumen af nitrogen:$$V =\frac{nRT}{P}$$
Givet:
- Temperatur, $$T =215 °C + 273 =488 K$$ (Konvertering af Celsius til Kelvin)
- Tryk, $$P =715 mmHg =715/760 =0,941 atm (Konvertering af mmHg til atm)$$
- Antal mol nitrogen, $$n =\frac{1}{3} \ gange 0,1 =0,033 mol$$
- Gaskonstant, $$R =0,08206 L * atm/mol * K$$
Tilslutning af værdierne:$$V =\frac{(0,033 mol) \times (0,08206 L * atm / mol * K) \times (488 K)}{0,941 atm}$$ $$V \ca. 1,14 L$$
Derfor kræves der cirka 1,14 liter nitrogen ved 215 °C og 715 mmHg for at reagere med 0,1 mol brint og producere ammoniak.
 Varme artikler
Varme artikler
-
 Guld nanopartikler til at finde anvendelser i brintøkonomiDen internationale videnskabelige gruppe udførte forsøget med halvleder baseret på titaniumdioxid. Kredit:Peter den Store St.Petersburg Polytechnic University Et internationalt hold af videnskabsm
Guld nanopartikler til at finde anvendelser i brintøkonomiDen internationale videnskabelige gruppe udførte forsøget med halvleder baseret på titaniumdioxid. Kredit:Peter den Store St.Petersburg Polytechnic University Et internationalt hold af videnskabsm -
 Ny beregningsmetode til lægemiddelopdagelseForsidebilledet illustrerer TauRAMD-metoden, som er baseret på Random Acceleration Molecular Dynamics-teknikken og designet til beregning af de relative opholdstider, tau, af lægemiddellignende forbin
Ny beregningsmetode til lægemiddelopdagelseForsidebilledet illustrerer TauRAMD-metoden, som er baseret på Random Acceleration Molecular Dynamics-teknikken og designet til beregning af de relative opholdstider, tau, af lægemiddellignende forbin -
 Ny to-polymer membran øger brintbrændselscellens ydeevneEn ny polymer ionbyttermembran fremstillet ved hjælp af en ny metode kan realisere billigere og højere ydeevne brændselsceller end de eksisterende, tager os et skridt tættere på at realisere en brintø
Ny to-polymer membran øger brintbrændselscellens ydeevneEn ny polymer ionbyttermembran fremstillet ved hjælp af en ny metode kan realisere billigere og højere ydeevne brændselsceller end de eksisterende, tager os et skridt tættere på at realisere en brintø -
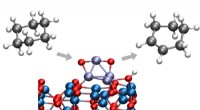 Forskere er banebrydende for den nye kemiske konverteringsproces ved lav temperaturArgonne -kemikere har identificeret en måde at konvertere cyclohexan til cyclohexen eller cyclohexadien, begge vigtige kemikalier i en lang række industrielle processer. Den nye proces finder sted ved
Forskere er banebrydende for den nye kemiske konverteringsproces ved lav temperaturArgonne -kemikere har identificeret en måde at konvertere cyclohexan til cyclohexen eller cyclohexadien, begge vigtige kemikalier i en lang række industrielle processer. Den nye proces finder sted ved
- Forskere opdager klynger af galakser i det tidlige univers
- Sådan beregnes netmomentet
- En ny retning af topologisk forskning er klar til start
- Ultrahøj piezoelektrisk ydeevne demonstreret i keramiske materialer
- Undersøgelse:En kontroversiel SEC-regel gjorde ikke meget for at tøjle overdreven CEO-løn
- Amazonas regnskov kan være mere modstandsdygtig over for skovrydning end tidligere antaget


