1 Lithium reagerer spontant med brom for at producere bromid Skriv den afbalancerede kemiske ligning for reaktion Hvis 25,0 g af og er til stede i begyndelsen?
2Li(s) + Br2(l) → 2LiBr(s)
Givet:
Masse af lithium (Li) =25,0 g
Masse af brom (Br2) =100 g
For at bestemme den begrænsende reaktant og beregne massen af dannet lithiumbromid (LiBr), skal vi sammenligne molforholdet mellem reaktanterne med deres støkiometriske koefficienter i den afbalancerede kemiske ligning.
Konverter masserne af Li og Br2 til mol:
Mol Li =25,0 g / 6,941 g/mol =3,605 mol
Mol Br2 =100 g / 159,81 g/mol =0,626 mol
Beregn molforholdet mellem reaktanter:
Li:Br2 =3,605 mol/2:0,626 mol/1
Li:Br2 =1,8025:0,626
Li :Br2 ≈ 3 :1
Ved at sammenligne molforholdet med det støkiometriske forhold på 2:1 i den afbalancerede ligning, kan vi observere, at lithium er den begrænsende reaktant, da det er til stede i et mindre molforhold sammenlignet med brom.
Derfor vil alt lithium reagere, og mængden af dannet LiBr vil blive bestemt af mængden af lithium.
Beregn nu molerne af LiBr dannet ved hjælp af støkiometrien fra den afbalancerede ligning:
Mol LiBr =Mol Li × (2 mol LiBr / 2 mol Li)
Mol LiBr =3,605 mol × 1
Mol LiBr =3,605 mol
Til sidst konverterer du mol LiBr til gram:
Masse af LiBr =Mol af LiBr × Molær masse af LiBr
Masse af LiBr =3,605 mol x 86,85 g/mol
Masse af LiBr =312,35 g
Derfor er massen af lithiumbromid (LiBr), der dannes, når 25,0 g lithium og 100 g brom reagerer, 312,35 g.
Sidste artikelHvad er forskellen med kodeinphosphat og dihydrocodein?
Næste artikelHvad er ordligningen for phenol og bromvand?
 Varme artikler
Varme artikler
-
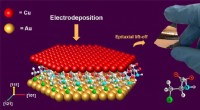 Forskere bruger aminosyrer til at dyrke højtydende kobber tynde filmKobbertynde film fremstilles ved elektroaflejring af kobber, Cu (111), på et selvsamlet organisk monolag af aminosyren L-cystein på guld, Au (111). Kredit:Bin Luo For første gang, forskere fra Mis
Forskere bruger aminosyrer til at dyrke højtydende kobber tynde filmKobbertynde film fremstilles ved elektroaflejring af kobber, Cu (111), på et selvsamlet organisk monolag af aminosyren L-cystein på guld, Au (111). Kredit:Bin Luo For første gang, forskere fra Mis -
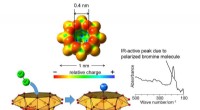 Polarisering af brommolekyle i vanadiumoxidklyngehulrum og ny alkanbromeringSpektrets top på grund af polariseret brommolekyle. Kredit:Kanazawa University Alkaner er hovedbestanddelene i naturgas og olie, kun bestående af kulstof- og brintatomer. CH-bindingerne af alkaner
Polarisering af brommolekyle i vanadiumoxidklyngehulrum og ny alkanbromeringSpektrets top på grund af polariseret brommolekyle. Kredit:Kanazawa University Alkaner er hovedbestanddelene i naturgas og olie, kun bestående af kulstof- og brintatomer. CH-bindingerne af alkaner -
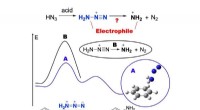 Kemikere beviser mekanismen for direkte aminering fra benzenDet grafiske abstrakt af direkte aminering. Kredit:Tomsk Polytechnic University (TPU) Et team af kemikere fra Tomsk Polytekniske Universitet opdagede en mekanisme for direkte elektrofil aminering
Kemikere beviser mekanismen for direkte aminering fra benzenDet grafiske abstrakt af direkte aminering. Kredit:Tomsk Polytechnic University (TPU) Et team af kemikere fra Tomsk Polytekniske Universitet opdagede en mekanisme for direkte elektrofil aminering -
 Video:Kemien bag kibbleKredit:The American Chemical Society Har du nogensinde tænkt over, hvor mærkeligt det er, at hunde spiser disse tørre, underligt lugtende stykker mad for hele deres liv og aldrig blive træt af dem
Video:Kemien bag kibbleKredit:The American Chemical Society Har du nogensinde tænkt over, hvor mærkeligt det er, at hunde spiser disse tørre, underligt lugtende stykker mad for hele deres liv og aldrig blive træt af dem
- Kinas rumsonde sender sit første billede af Mars tilbage
- Nedefra og op:Manipulering af nanobånd på molekylært niveau
- IBM-forskere måler energiniveauerne af enkelte molekyler på isolatorer
- Hvor er guld- og sølvminerne i USA?
- Hvad havfugle kan fortælle os om tidevandet
- Forskere skaber fleksible biokompatible cilia, der kan styres af en magnet


