Hvorfor er hydrogenchlorid polært?
I hydrogenchlorid er elektronegativiteten af chlor 3,0, mens elektronegativiteten af brint er 2,1. Det betyder, at klor har en stærkere tiltrækning af elektroner end brint. Som et resultat trækkes elektronerne i hydrogenchloridmolekylet mod kloratomet, hvilket skaber en polær binding.
Den polære binding i hydrogenchlorid skaber en positiv ladning på brintatomet og en negativ ladning på kloratomet. Denne ladningsadskillelse gør hydrogenchlorid til et polært molekyle.
Polære molekyler er vigtige, fordi de kan interagere med hinanden gennem dipol-dipol-interaktioner. Disse interaktioner er forårsaget af tiltrækningen mellem den positive ladning af et molekyle og den negative ladning af et andet molekyle. Dipol-dipol-interaktioner er ansvarlige for mange af egenskaberne ved polære molekyler, såsom deres høje kogepunkter og opløselighed i vand.
 Varme artikler
Varme artikler
-
 Nye fund hjælper med at designe meget effektiv metaloxidkatalysator til fjernelse af ozonKredit:Pixabay/CC0 Public Domain Atmosfærisk ozon (O 3 ) er blevet en af de største luftforurenende stoffer. Katalytisk nedbrydning er en effektiv og økonomisk teknologi i O 3 fjernelse, hvo
Nye fund hjælper med at designe meget effektiv metaloxidkatalysator til fjernelse af ozonKredit:Pixabay/CC0 Public Domain Atmosfærisk ozon (O 3 ) er blevet en af de største luftforurenende stoffer. Katalytisk nedbrydning er en effektiv og økonomisk teknologi i O 3 fjernelse, hvo -
 Frøet, der kunne bringe rent vand til millioner(venstre) Uskallede M. oleifera frø, (mellem) afskallede frø, (til højre) knuste frø før proteinekstraktion Kredit:Carnegie Mellon University College of Engineering Ifølge FN, 2,1 milliarder menne
Frøet, der kunne bringe rent vand til millioner(venstre) Uskallede M. oleifera frø, (mellem) afskallede frø, (til højre) knuste frø før proteinekstraktion Kredit:Carnegie Mellon University College of Engineering Ifølge FN, 2,1 milliarder menne -
 Team skaber ny ultraletvægt, knusningsbestandige tensegrity-metamaterialerNye tensegrity-metamaterialer fra UCI og Georgia Institute of Technology-forskere anvender isolerede kompressionsløkkeelementer, der udelukkende er forbundet gennem et kontinuerligt netværk af trækele
Team skaber ny ultraletvægt, knusningsbestandige tensegrity-metamaterialerNye tensegrity-metamaterialer fra UCI og Georgia Institute of Technology-forskere anvender isolerede kompressionsløkkeelementer, der udelukkende er forbundet gennem et kontinuerligt netværk af trækele -
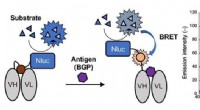 Nyt lys:En ny type immunosensor til immunoassay-testsEnzymet Nluc tilsættes til Q-legemet og danner et Bret Q-legeme. Luminescens observeres ved antigenbinding. Til højre, emissionsspektre i nærvær af substratet af BRET-Q-legemet mærket med det fluoresc
Nyt lys:En ny type immunosensor til immunoassay-testsEnzymet Nluc tilsættes til Q-legemet og danner et Bret Q-legeme. Luminescens observeres ved antigenbinding. Til højre, emissionsspektre i nærvær af substratet af BRET-Q-legemet mærket med det fluoresc
- Nye ATLAS -præcisionsmålinger af Higgs Boson i den gyldne kanal
- Lab-teamet udvikler hyper-strækbar elastisk-komposit energihøstere
- Hvilken katalysator bruges til at adskille svovl fra olie?
- Elektrokemiens gennembrud forenkler skabelsen af eftertragtede molekyler til lægemidler, elektron…
- Starship Mk1 blæser sin top under test
- Hvordan små vanddråber dannes kan have stor indflydelse på klimamodeller


