Hvordan adskiller brint sig fra halogener?
1. Reaktivitet: Brint er et meget reaktivt grundstof, mens halogener også er meget reaktive. Imidlertid stammer brints reaktivitet fra dets evne til at miste en elektron og blive en positivt ladet ion (H+). I modsætning hertil reagerer halogener ved at få en elektron til at danne negativt ladede ioner (halogenidioner).
2. Elektronkonfiguration: Hydrogen har en valenselektron, hvilket gør den univalent. Halogener har på den anden side syv valenselektroner, hvilket gør dem monovalente. Denne forskel i elektronkonfiguration resulterer i forskellig kemisk adfærd.
3. Oxidationstilstande: Brint kan udvise både positive (+1) og negative (-1) oxidationstilstande, der danner henholdsvis hydridioner (H-) og protoner (H+). Halogener udviser på den anden side for det meste negative oxidationstilstande og danner halogenidioner (X-), når de får en elektron.
4. Kemisk binding: Hydrogen kan deltage i forskellige typer kemisk binding, herunder kovalent, ionisk og metallisk binding. Halogener danner primært kovalente bindinger med andre grundstoffer.
5. Fysiske egenskaber: Brint er en farveløs, lugtfri, diatomisk gas ved stuetemperatur. Halogener er diatomiske gasser ved stuetemperatur, men deres farver varierer. For eksempel er fluor (F2) bleggul, chlor (Cl2) er grønlig-gul, brom (Br2) er rødbrun, og jod (I2) er sort.
6. Smelte- og kogepunkter: Brint har relativt lave smelte- og kogepunkter sammenlignet med halogener. Dette skyldes, at brintmolekyler kun holdes sammen af svage Van der Waals-kræfter. Halogener har stærkere kovalente bindinger, hvilket resulterer i højere smelte- og kogepunkter.
7. Forekomst og overflod: Brint er det mest udbredte grundstof i universet, mens halogener er relativt sjældne. Brint findes primært i vand og kulbrintebrændstoffer, hvorimod halogener er til stede som salte i havvand og forskellige mineraler.
8. Toksicitet: Brint er ikke-giftigt, men halogener kan være giftige på forskellige måder. For eksempel er fluor ætsende for levende væv, klor er et desinfektionsmiddel, brom kan forårsage forbrændinger og irritation af huden, og jod er et antiseptisk middel og kan være giftigt, hvis det indtages i høje doser.
Generelt adskiller brint sig fra halogener med hensyn til reaktivitet, elektronkonfiguration, oxidationstilstande, kemisk binding, fysiske egenskaber, forekomst og overflod og toksicitet. Disse forskelle tilskrives variationerne i deres atomare strukturer og elektronarrangementer.
 Varme artikler
Varme artikler
-
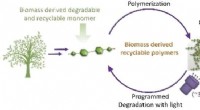 Udvikling af en nedbrydningsudløsende plast lavet af vanillinKredit:Wiley-VCH Fra billige masseprodukter til skræddersyede højteknologiske materialer, vores moderne verden uden plastik er utænkelig. Den største ulempe ved dette er brugen af fossile brændst
Udvikling af en nedbrydningsudløsende plast lavet af vanillinKredit:Wiley-VCH Fra billige masseprodukter til skræddersyede højteknologiske materialer, vores moderne verden uden plastik er utænkelig. Den største ulempe ved dette er brugen af fossile brændst -
 At omdanne et farligt toksin til en biosensorKredit:Chan Cao, EPFL Nogle typer bakterier har evnen til at slå huller ind i andre celler og dræbe dem. Det gør de ved at frigive specialiserede proteiner kaldet poredannende toksiner (PFTer), de
At omdanne et farligt toksin til en biosensorKredit:Chan Cao, EPFL Nogle typer bakterier har evnen til at slå huller ind i andre celler og dræbe dem. Det gør de ved at frigive specialiserede proteiner kaldet poredannende toksiner (PFTer), de -
 Nyopdaget materiale kan lette slitage på udenjordiske køretøjerKredit:Pixabay/CC0 Public Domain Mens NASAs Mars Perseverance Rover fortsætter med at udforske Mars overflade, forskere på Jorden har udviklet en ny nanoskala metalcarbid, der kunne fungere som et
Nyopdaget materiale kan lette slitage på udenjordiske køretøjerKredit:Pixabay/CC0 Public Domain Mens NASAs Mars Perseverance Rover fortsætter med at udforske Mars overflade, forskere på Jorden har udviklet en ny nanoskala metalcarbid, der kunne fungere som et -
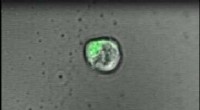 Forskere fremmer oprettelsen af kunstig lymfeknude til bekæmpelse af kræft, andre sygdommeT-celler interagerer med den transparente gel. Kredit:Hawley Pruitt I et principbeskyttet studie på mus, forskere ved Johns Hopkins Medicine rapporterer oprettelsen af en specialiseret gel, der
Forskere fremmer oprettelsen af kunstig lymfeknude til bekæmpelse af kræft, andre sygdommeT-celler interagerer med den transparente gel. Kredit:Hawley Pruitt I et principbeskyttet studie på mus, forskere ved Johns Hopkins Medicine rapporterer oprettelsen af en specialiseret gel, der
- Forskellene mellem catecholaminer og cortisol
- Hvad er et eksempel på sten- og bjergkorrelatin i teorien om kontinentaldrift?
- Ny forskning viser, hvordan man studerer lave koncentrationer af elektroner i komplekse oxidfilm
- Brug af droner til at forenkle filmanimation
- Vil vi se et kontantløst samfund komme ud af pandemien?
- NASA finder potentiale for kraftig nedbør i den nye tropiske cyklon Trevor


