At omdanne et farligt toksin til en biosensor
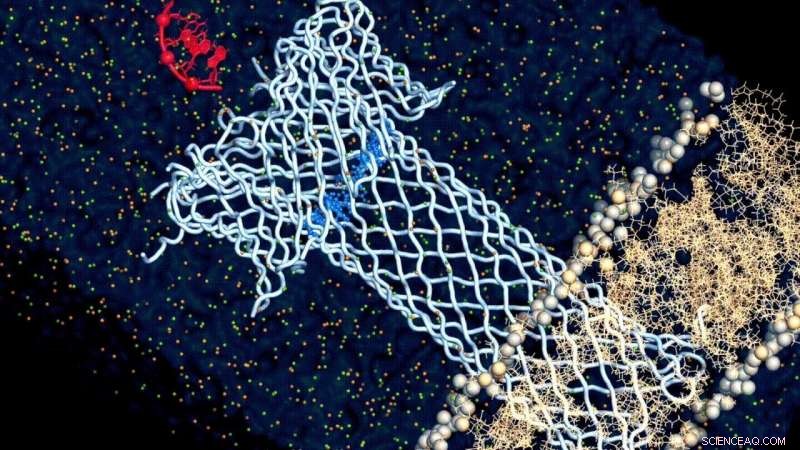
Kredit:Chan Cao, EPFL
Nogle typer bakterier har evnen til at slå huller ind i andre celler og dræbe dem. Det gør de ved at frigive specialiserede proteiner kaldet "poredannende toksiner" (PFT'er), der låser sig fast på cellens membran og danner en rørlignende kanal, der går igennem den. Denne struktur på tværs af membranen kaldes en pore. Punkteret af flere PFT'er, målcellen selvdestruerer.
Imidlertid, PFT'er har fået stor interesse ud over bakterielle infektioner. Porerne i nanostørrelse, som de danner, bruges til at registrere biomolekyler:Et biologisk molekyle, f.eks., DNA eller RNA, passerer gennem nanoporen som en streng styret af en spænding, og dets individuelle komponenter (f.eks. nukleinsyrer i DNA) udsender distinkte elektriske signaler, der kan udlæses. Faktisk, nanopore sensing er allerede på markedet som et vigtigt værktøj til DNA- eller RNA-sekventering.
Udgiver i Naturkommunikation , forskere ledet af Matteo Dal Peraro ved EPFL har studeret en anden større PFT, der kan bruges effektivt til mere kompleks sansning, såsom proteinsekventering. Toksinet er aerolysin, som produceres af bakterien Aeromonas hydrophila, og er det "stiftende medlem" af en større familie af PFT'er, der findes på tværs af mange organismer.
En af de vigtigste fordele ved aerolysin er, at det danner meget smalle porer, der kan skelne mellem molekyler med meget højere opløsning end andre toksiner. Tidligere undersøgelser har vist, at aerolysin kan bruges til at "sanse" flere biomolekyler, men der har været få undersøgelser af forholdet mellem aerolysins struktur og dets molekylære sanseevner.
Forskerne brugte først en strukturel model af aerolysin til at studere dens struktur med computersimuleringer. Som et protein, aerolysin består af aminosyrer, og modellen hjalp forskerne med at forstå, hvordan disse aminosyrer påvirker funktionen af aerolysin generelt.
Da de først havde fået fat i forholdet, forskerne ændrede strategisk aminosyrer i computermodellen. Modellen forudsagde derefter den mulige indvirkning af hver ændring på den overordnede funktion af aerolysin.
Ved afslutningen af beregningsprocessen, Dr. Chan Cao, den førende forfatter til dette værk, produceret 16 gensplejsede, "mutante" aerolysinporer, indlejrede dem i lipid-dobbeltlag for at simulere deres position i en cellemembran, og udførte forskellige målinger (enkeltkanalsoptagelse og molekylære translokationseksperimenter) for at forstå, hvordan ionkonduktans, ionselektivitet, og translokationsegenskaber af aerolysinporen reguleres på molekylært niveau.
Og med denne tilgang, forskerne fandt endelig, hvad der driver forholdet mellem strukturen og funktionen af aerolysin:dets hætte. Aerolysin-poren er ikke bare et rør, der går gennem membranen, men har også en hættelignende struktur, der tiltrækker og binder målmolekylet og "trækker" det gennem porens kanal. Og undersøgelsen fandt ud af, at det er elektrostatikken i denne hætteregion, der dikterer dette forhold.
"Ved at forstå detaljerne i, hvordan strukturen af aerolysinporen forbinder dens funktion, vi kan nu konstruere brugerdefinerede porer til forskellige sensorapplikationer, " siger Dal Peraro. "Disse ville åbne nye, uudforskede muligheder for at sekventere biomolekyler som DNA, proteiner og deres post-translationelle modifikationer med lovende anvendelser inden for gensekventering og biomarkørdetektion til diagnostik." Forskerne har allerede indgivet patent på deres sekventering og karakterisering af de genetisk manipulerede aerolysinporer.
 Varme artikler
Varme artikler
-
 Demonstration af et enkelt molekyle piezoelektrisk effektDen omvendte piezoelektriske effekt i enkelte heptahelicen-afledte molekyler. Kredit:Pavel Jelínek / Institut for Fysik i CAS Forskere fra Institut for Organisk Kemi og Biokemi i CAS (IOCB Prag) o
Demonstration af et enkelt molekyle piezoelektrisk effektDen omvendte piezoelektriske effekt i enkelte heptahelicen-afledte molekyler. Kredit:Pavel Jelínek / Institut for Fysik i CAS Forskere fra Institut for Organisk Kemi og Biokemi i CAS (IOCB Prag) o -
 At se atomer bevæge sig i hybride perovskitkrystaller afslører spor til forbedring af solcellerDet indvendige bagsidebillede af den 20. november, 2017 udgave af Avancerede materialer illustrerer, hvordan ionmigrering i en hybrid perovskitkrystal påvirker solcellernes ydeevne i forskellige omr
At se atomer bevæge sig i hybride perovskitkrystaller afslører spor til forbedring af solcellerDet indvendige bagsidebillede af den 20. november, 2017 udgave af Avancerede materialer illustrerer, hvordan ionmigrering i en hybrid perovskitkrystal påvirker solcellernes ydeevne i forskellige omr -
 Hvad er kilderne til CFC'er?Chlorofluorcarbons, også kendt som CFCer, består af kemiske forbindelser, der består af klor, fluor og kulstof. CFCer er især skadelige, når de frigøres i atmosfæren på grund af deres destruktive r
Hvad er kilderne til CFC'er?Chlorofluorcarbons, også kendt som CFCer, består af kemiske forbindelser, der består af klor, fluor og kulstof. CFCer er især skadelige, når de frigøres i atmosfæren på grund af deres destruktive r -
 Struktur af fedtforarbejdningsenzym bestemtKredit:CC0 Public Domain Efter årtiers arbejde uden succes, forskere har bestemt den høje opløsning, tredimensionel struktur for lipoproteinlipase, enzymet, der behandler fedtstoffer, eller trigly
Struktur af fedtforarbejdningsenzym bestemtKredit:CC0 Public Domain Efter årtiers arbejde uden succes, forskere har bestemt den høje opløsning, tredimensionel struktur for lipoproteinlipase, enzymet, der behandler fedtstoffer, eller trigly
- Nye nanoteknikker integrerer elektrongas-producerende oxider med silicium
- Rød himmel i sigte viser opladning i højden
- Nyt aluminium og samarium hexaborid-baseret kompositmateriale med næsten nul ekspansion
- Dynamisk vurdering kan hjælpe sprogelever til at få mere succes
- Hvad er en total solformørkelse, og hvorfor denne er så usædvanlig
- Nytilkomne og canadiske gymnasieelever er venlige, men ikke venner


