Hvorfor har svovl et højere smeltepunkt end klor?
1. Intermolekylære kræfter: Svovl eksisterer som S8-ringe i sin elementære form, som holdes sammen af kovalente bindinger. Disse kovalente bindinger er stærkere end de intermolekylære kræfter (van der Waals-kræfter), der er til stede mellem klormolekyler (Cl2). De stærkere intermolekylære kræfter i svovl kræver mere energi at overvinde for at smelte stoffet, hvilket resulterer i et højere smeltepunkt.
2. Molekylvægt: Molekylvægten af svovl (S8) er 256,5 g/mol, mens den for chlor (Cl2) er 70,9 g/mol. Den tungere molekylvægt af svovl betyder, at der kræves mere energi for at bryde bindingerne mellem dets molekyler, hvilket fører til et højere smeltepunkt.
3. Krystalstruktur: Svovl danner i sin faste tilstand en ortorhombisk krystalstruktur, hvor S8-ringene pakker sig effektivt og danner et stift gitter. På den anden side danner klor en molekylær krystalstruktur, hvor Cl2-molekyler holdes sammen af svage intermolekylære kræfter. Den mere stabile og stive krystalstruktur af svovl bidrager til dets højere smeltepunkt.
Sammenfattende resulterer de stærkere intermolekylære kræfter, højere molekylvægt og mere stabil krystalstruktur af svovl sammenlignet med chlor i et signifikant højere smeltepunkt for svovl (115,21 °C) sammenlignet med chlor (-101,5 °C).
Sidste artikelKobber og ilt reagerer for at danne kobber II-oxid?
Næste artikelHvad er blynitrat og ammoniumsulfat?
 Varme artikler
Varme artikler
-
 Samtale mellem en biolog og en filosof - er mennesket blevet en halvgud?Kredit:karamel/Pixabay To professorer fra universitetet i Lorraine fortsætter de udvekslinger, der tidligere blev indledt i Selvtransformation og religion og Identitet, metamorfose og selvet. Her b
Samtale mellem en biolog og en filosof - er mennesket blevet en halvgud?Kredit:karamel/Pixabay To professorer fra universitetet i Lorraine fortsætter de udvekslinger, der tidligere blev indledt i Selvtransformation og religion og Identitet, metamorfose og selvet. Her b -
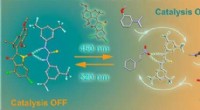 Lysstyret nanomaskine styrer katalyseSupramolekylær relæ-kontrol af organokatalyse med en hemithioindigo-baseret molekylær motor, Grafisk abstrakt. Visionen om fremtiden for miniaturisering har produceret en række syntetiske molekylæ
Lysstyret nanomaskine styrer katalyseSupramolekylær relæ-kontrol af organokatalyse med en hemithioindigo-baseret molekylær motor, Grafisk abstrakt. Visionen om fremtiden for miniaturisering har produceret en række syntetiske molekylæ -
 Nu kan metaloverflader være øjeblikkelige bakteriedræbereEn laser forbereder sig på at teksturere overfladen af kobber, forbedrer dets antimikrobielle egenskaber. Kredit:Purdue University /Kayla Wiles Bakterielle patogener kan leve på overflader i fle
Nu kan metaloverflader være øjeblikkelige bakteriedræbereEn laser forbereder sig på at teksturere overfladen af kobber, forbedrer dets antimikrobielle egenskaber. Kredit:Purdue University /Kayla Wiles Bakterielle patogener kan leve på overflader i fle -
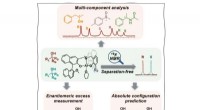 Fluor muliggør separationsfri chiral kromatografisk analyseMekanisme og hjælpeprogrammer i 19 F NMR-baseret separationsfri enantiodifferentiering. Kredit:Zhao Yanchun Forskere fra Shanghai Institute of Organic Chemistry fra det kinesiske videnskabsakade
Fluor muliggør separationsfri chiral kromatografisk analyseMekanisme og hjælpeprogrammer i 19 F NMR-baseret separationsfri enantiodifferentiering. Kredit:Zhao Yanchun Forskere fra Shanghai Institute of Organic Chemistry fra det kinesiske videnskabsakade
- Autoshow ligner mere CES end ikke
- Katalysatoroverflade analyseret ved atomopløsning
- Ny sensor til måling af atmosfæriske aerosoler og nitrogendioxid samtidigt
- Opløsning af den interne struktur af nanopartikeldimerer forbundet med DNA
- Hvordan man opbygger et sort hul til en videnskabelige messe Project
- Død zone forudsigelse:Større end gennemsnittet; ikke nær rekord


