Hcl nahco3 nacl H2O CO2 reaktionens enthalpi?
HCl + NaHCO3 + NaCl + H2O + CO2
Entalpiændringen for denne reaktion kan beregnes ved hjælp af følgende ligning:
ΔH =ΣnΔHf(produkter) - ΣnΔHf(reaktanter)
hvor ΔH er entalpiændringen, n er antallet af mol af hvert stof, og ΔHf er standardentalpien for dannelse af hvert stof.
Standardentalpierne for dannelse for de stoffer, der er involveret i reaktionen, er:
HCI:-167,2 kJ/mol
NaHC03:-950,8 kJ/mol
NaCl:-411,2 kJ/mol
H2O:-285,8 kJ/mol
CO2:-393,5 kJ/mol
Ved at indsætte disse værdier i ligningen får vi:
ΔH =[1(-393,5 kJ/mol) + 1(-411,2 kJ/mol)] - [1(-167,2 kJ/mol) + 1(-950,8 kJ/mol)]
ΔH =-804,7 kJ/mol + 1118 kJ/mol
ΔH =313,3 kJ/mol
Derfor er entalpiændringen for reaktionen 313,3 kJ/mol. Det betyder, at reaktionen er endoterm, hvilket betyder, at den optager varme fra omgivelserne.
Sidste artikelHvordan beregner du fordampningshastigheden af methanol?
Næste artikelHvad er anvendelsen af jodtrichlorid?
 Varme artikler
Varme artikler
-
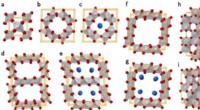 Struktur-egenskabsforhold i nanoporøse og amorfe iridiumoxiderAtom- og krystalstrukturer af de krystallinske iridiumoxider. en Rutil-type R-IrO2 . b Hollandite-type Ho-IrO2 . c K-interkaleret hollandit-type 1K + Ho-IrO2 . d Romanechit-type Ro-IrO2 . e K-interkal
Struktur-egenskabsforhold i nanoporøse og amorfe iridiumoxiderAtom- og krystalstrukturer af de krystallinske iridiumoxider. en Rutil-type R-IrO2 . b Hollandite-type Ho-IrO2 . c K-interkaleret hollandit-type 1K + Ho-IrO2 . d Romanechit-type Ro-IrO2 . e K-interkal -
 Mysteriet om en Picasso afsløret af videnskabsmændKredit:Museu Picasso, Barcelona. Foto:Gasull Fotografia I sommeren 1917 i Barcelona, Picasso arbejdede på fire malerier inspireret af Ballets Russes, bruge et lignende sæt materiale til dem alle,
Mysteriet om en Picasso afsløret af videnskabsmændKredit:Museu Picasso, Barcelona. Foto:Gasull Fotografia I sommeren 1917 i Barcelona, Picasso arbejdede på fire malerier inspireret af Ballets Russes, bruge et lignende sæt materiale til dem alle, -
 Forskere beregner stråledosis i knoglerester fra Hiroshima-bombeofferetI en artikel offentliggjort i PLOS ET , Brasilianske forskere beskriver den første retrospektive dosimetriske undersøgelse ved elektronspin-resonansspektroskopi ved hjælp af menneskeligt væv fra ato
Forskere beregner stråledosis i knoglerester fra Hiroshima-bombeofferetI en artikel offentliggjort i PLOS ET , Brasilianske forskere beskriver den første retrospektive dosimetriske undersøgelse ved elektronspin-resonansspektroskopi ved hjælp af menneskeligt væv fra ato -
 Højhastighedsfilm hjælper videnskabsmænd, der designer glødende molekylerAequorea victoria, også kaldet krystalgeléen, er en selvlysende vandmand, der lever nær Stillehavskysten i Nordamerika. Kredit:Gary Kavanagh/iStockphoto.com Krystalvandmændene svømmer ud for Still
Højhastighedsfilm hjælper videnskabsmænd, der designer glødende molekylerAequorea victoria, også kaldet krystalgeléen, er en selvlysende vandmand, der lever nær Stillehavskysten i Nordamerika. Kredit:Gary Kavanagh/iStockphoto.com Krystalvandmændene svømmer ud for Still
- FN:Klimaændringer underbygger arbejdet med at stoppe fattigdom, sult
- Amazon ser, lytter og sporer dig. Sådan stopper du det
- Magnetiske T-Budbots lavet af teplanter dræber og renser biofilm
- Trin med DNA-transkription
- Kan vi bæredygtigt høste træer fra tropiske skove?
- Kobberstriber hjælper med at stryge pnictidlåsen i isolerende tilstand


