Højhastighedsfilm hjælper videnskabsmænd, der designer glødende molekyler

Aequorea victoria, også kaldet krystalgeléen, er en selvlysende vandmand, der lever nær Stillehavskysten i Nordamerika. Kredit:Gary Kavanagh/iStockphoto.com
Krystalvandmændene svømmer ud for Stillehavets nordvestlige kyst og kan oplyse vandet, når de bliver forstyrret. Den glød kommer fra proteiner, der absorberer energi og derefter frigiver den som lyse blink.
For at spore mange af livets aktiviteter, biologer tog et signal fra den samme vandmand.
Forskere indsamlede et af proteinerne fundet i havdyrene, grønt fluorescerende protein (GFP), og konstrueret en molekylær lyskontakt, der ville lyse eller forblive mørk afhængigt af specifikke eksperimentelle forhold. De glødende etiketter er knyttet til molekyler i levende celler, så forskere kan fremhæve dem under billeddannelsesforsøg. De bruger disse fluorescerende markører til at forstå, hvordan en celle reagerer på ændringer i sit miljø, identificere hvilke molekyler der interagerer i en celle og spore virkningerne af genetiske mutationer.
Forskere har studeret GFP og andre fluorescerende proteiner i årtier for bedre at forstå deres glødende virkning og forbedre deres funktion i videnskabelige undersøgelser, men de har aldrig været i stand til at observere de ultrahurtige ændringer, der sker mellem "off" og "on" tilstande indtil nu.
I et nyligt eksperiment udført på Department of Energy's SLAC National Accelerator Laboratory, et forskerhold brugte lyse, ultrahurtige røntgenimpulser fra SLAC's røntgenfri-elektronlaser for at skabe en højhastighedsfilm af et fluorescerende protein i aktion. Med den information, forskerne begyndte at designe en markør, der skifter lettere, en kvalitet, der kan forbedre opløsningen under biologisk billeddannelse.
"Vi tror, at denne tilgang vil åbne en verden af muligheder for at skræddersy fluorescerende proteiner, siger Martin Weik, videnskabsmand ved Institut for Strukturel Biologi i Grenoble, Frankrig og en af forfatterne på udgivelsen. "Vi har ikke kun strukturen af det fluorescerende protein, men nu kan vi se, hvad der sker mellem den ene statiske tilstand og den anden."
Naturkemi offentliggjorde undersøgelsen den 11. september.
Optagelse af en Molecular Light Switch
For at observere disse mellemtilstande, forskerne igangsatte en fotokemisk reaktion i det fluorescerende protein med en optisk laser ved det kohærente røntgenbillede ved Linac Coherent Light Source, efterfulgt af røntgenbilleder med tydelige tidsforsinkelser. Den optiske laser giver energi i form af fotoner, efterligne, hvad der sker i naturen.
"Atomer bevæger sig rundt i det fotoaktive sted af molekylet som et resultat af absorption af en foton, siger Sebastien Boutet, SLAC videnskabsmand og medforfatter til papiret. "Denne strukturelle ændring forvandler proteinet fra en mørk tilstand til en lysemitterende (fluorescerende) tilstand."

Coherent X-Ray Imaging (CXI) instrumentet gør brug af de strålende hårde røntgenimpulser fra Linac Coherent Light Source. Udstyret er skræddersyet til røntgenkrystallografiske eksperimenter. Kredit:SLAC National Accelerator Laboratory
Der er en stor mængde litteratur, der beregner, hvad der kan ske mellem de to stater, men ingen, der studerede proteinet, var i stand til at se de strukturelle ændringer i omskifteren, når fotonen absorberes. Det molekylære skifte var bare for hurtigt til traditionelle røntgenbilledteknikker.
I dette studie, femtosekunds røntgenimpulser genereret af LCLS – der ankommer på kun milliontedele af en milliardtedel af et sekund – gjorde det muligt for teamet at skabe stop-action billeder af processen med et ekstremt tæt interval, efter at proteinerne blev aktiveret af den optiske laser.
En halvåben dør
Højhastigheds-snapshots blev brugt til at generere en film fra den mørke tilstand, og gav forskerne indsigt, som de brugte til at designe mere effektive omskiftelige lys-emitterende proteiner. De fandt et fingerpeg om den tid, molekylerne brugte mellem fluorescerende og ikke-fluorescerende tilstande.
"Efter et picosekund, og i meget kort tid, denne molekylære kontakt sidder fast mellem tændt og slukket, siger Ilme Schlichting, videnskabsmand ved Max-Planck Instituttet i Heidelberg, Tyskland og en af forfatterne på udgivelsen. "Folk har forudsagt dette, men faktisk at visualisere dens struktur er ekstremt spændende."
"Det er, som om der er en dør, og den er hverken lukket eller helt åben; den er halvt åben, " siger hun. "Og nu lærer vi, hvad der kan gå gennem døren, hvad der kan blokere det, og hvordan det virker i realtid."
I dette studie, forskerne fandt ud af, at en aminosyre blokerede døren og forhindrede kontakten i at dreje så let som muligt.
Forskerne forkortede aminosyren i en muteret version af det fluorescerende protein. Denne konstruerede version skiftede lettere og gav bedre kontrast. Disse egenskaber vil gøre det muligt for forskere at observere cellulær aktivitet med større præcision.
"Kontrast er afgørende i billeddannelse. Det er ligesom på en tv-skærm, hvor kan man se det bedste billede, du vil have, at mørket skal være ekstremt mørkt, og at farven skal være super lys og farverig, " siger Jacques-Philippe Colletier, en videnskabsmand ved Institut for Strukturel Biologi, der bidrog til forskningen.
Denne nye molekylære film med de vandmænd-inspirerede proteiner lyser vejen til at fange flere af livets mikroskopiske detaljer. Holdet vil fortsætte med at finjustere proteinet til andre ønskede egenskaber, der gør det ideelt til "superopløsningsmikroskopi, "en type lysmikroskopi, hvor forskere er i stand til at se oplyste detaljer af celler, der ikke kan skelnes med konventionelle lysmikroskopimetoder.
 Varme artikler
Varme artikler
-
 Heteractis magnifica søanemoner kan hjælpe med at bekæmpe Alzheimers sygdomEn storslået søanemone, der rider på strømmen ved Madivaru Manta Point. Kredit:Neville Wootton Heteractis magnifica søanemoner indeholder neurobeskyttende peptider, der bremser inflammationsproces
Heteractis magnifica søanemoner kan hjælpe med at bekæmpe Alzheimers sygdomEn storslået søanemone, der rider på strømmen ved Madivaru Manta Point. Kredit:Neville Wootton Heteractis magnifica søanemoner indeholder neurobeskyttende peptider, der bremser inflammationsproces -
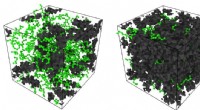 Tæt mellemrum spids tilstedeværelse af petrokemikalierSimuleringssnapshots af Rice University-ingeniører viser n-heptan-molekyler (grøn) under forskellige grader af indeslutning i en polymermatrix af molekyler (sort), hvor den højviskose polymer er en mo
Tæt mellemrum spids tilstedeværelse af petrokemikalierSimuleringssnapshots af Rice University-ingeniører viser n-heptan-molekyler (grøn) under forskellige grader af indeslutning i en polymermatrix af molekyler (sort), hvor den højviskose polymer er en mo -
 Forebyggelse af infektion, lette helbredelse:Nye biomaterialer fra edderkoppesilkeScanning af elektronmikroskopbilleder giver et overvældende bevis på forskellen. Til venstre:En biofilm dannes på overfladen af polycaprolacton, en bionedbrydelig plast, der ofte bruges i medicin. T
Forebyggelse af infektion, lette helbredelse:Nye biomaterialer fra edderkoppesilkeScanning af elektronmikroskopbilleder giver et overvældende bevis på forskellen. Til venstre:En biofilm dannes på overfladen af polycaprolacton, en bionedbrydelig plast, der ofte bruges i medicin. T -
 Kumarinforbindelser fra egetræsfade kunne bidrage til bitter smag i vin og spiritusKredit:Pixabay/CC0 Public Domain Vin og spiritus er komplekse blandinger af smags- og aromaforbindelser, hvoraf nogle opstår under lagring i træfade. Blandt andre forbindelser, egetræ frigiver kum
Kumarinforbindelser fra egetræsfade kunne bidrage til bitter smag i vin og spiritusKredit:Pixabay/CC0 Public Domain Vin og spiritus er komplekse blandinger af smags- og aromaforbindelser, hvoraf nogle opstår under lagring i træfade. Blandt andre forbindelser, egetræ frigiver kum
- Sådan dyrker du Borax Crystals
- Sådan beregnes bindingsenergi
- Implikationer af kraftfuld DNA-ændrende teknologi er for vigtige til at blive overladt til videnska…
- Homo erectus håndøkse fundet i Østafrika
- ALMA opløser gas påvirket af unge jetfly fra supermassive sorte hul
- Instrument på BESSY II viser, hvordan lys aktiverer molybdændisulfidlag til at blive katalysatorer


