Hvordan dannes H2O?
1. Dissociation af hydrogen og ilt:
- Brint og oxygen eksisterer som diatomiske molekyler, hvilket betyder, at de er opbygget af to atomer bundet sammen.
- For at vand kan dannes, skal disse diatomiske molekyler adskilles og bryde bindingerne mellem de enkelte brint- og oxygenatomer.
2. Elektronoverførsel:
- Hydrogenatomer har én valenselektron, mens oxygenatomer har seks valenselektroner.
- Under den kemiske reaktion donerer brintatomer deres enkeltvalenselektron til oxygenatomer.
- Denne elektronoverførsel skaber positivt ladede brintioner (H+) og negativt ladede oxygenioner (O-).
3. Dannelse af kovalente bindinger:
- Brintionerne (H+) og oxygenionerne (O-) tiltrækkes af hinanden på grund af deres modsatte ladninger.
- Disse ioner kommer sammen og danner kovalente bindinger ved at dele elektroner.
- Hvert oxygenatom deler sine to valenselektroner med to brintatomer og danner to kovalente bindinger.
4. Vandets molekylære struktur:
- De kovalente bindinger mellem brint- og oxygenatomerne resulterer i dannelsen af vandmolekyler.
- Hvert vandmolekyle har to brintatomer kovalent bundet til et oxygenatom, hvilket giver det en molekylformel H2O.
5. Hydrogenbinding:
- Udover de kovalente bindinger deltager vandmolekyler også i hydrogenbindingen.
- Hydrogenbinding involverer en lille positiv ladning på brintatomerne og en lille negativ ladning på oxygenatomet, hvilket skaber en dipol.
- Denne dipol tillader vandmolekyler at danne intermolekylære bindinger med hinanden, hvilket resulterer i vands karakteristiske egenskaber såsom høj overfladespænding, høj specifik varmekapacitet og dets evne til at fungere som et universelt opløsningsmiddel.
Overordnet set involverer dannelsen af H2O dissociation af hydrogen- og oxygenmolekyler, elektronoverførsel, kovalent bindingsdannelse og hydrogenbinding, hvilket fører til dannelsen af vandmolekyler med deres unikke egenskaber.
Sidste artikelHvor tæt er brom?
Næste artikelHvad er den procentvise sammensætning af FeO?
 Varme artikler
Varme artikler
-
 Forskergruppe finder på at omdanne plastikaffaldsprodukter til jetbrændstofDr. Hanwu Lei og hans forskerhold i laboratoriet, arbejder på at finde en anvendelse til plastaffald. Kredit:Washington State University En forskergruppe ledet af videnskabsmænd fra Washington Sta
Forskergruppe finder på at omdanne plastikaffaldsprodukter til jetbrændstofDr. Hanwu Lei og hans forskerhold i laboratoriet, arbejder på at finde en anvendelse til plastaffald. Kredit:Washington State University En forskergruppe ledet af videnskabsmænd fra Washington Sta -
 Retskemiske laserteknik skelner mellem menneske- og dyreblodIgor Lednev har en prototype af en scanner, der kan bruges af retshåndhævere til at analysere biologiske pletter på gerningssteder. Kredit:University at Albany Ny forskning udgivet af retskemiker
Retskemiske laserteknik skelner mellem menneske- og dyreblodIgor Lednev har en prototype af en scanner, der kan bruges af retshåndhævere til at analysere biologiske pletter på gerningssteder. Kredit:University at Albany Ny forskning udgivet af retskemiker -
 Ny katalysator bevist effektiv i elektrosyntese af ammoniakSkematisk illustration af den syntetiske proces af Mo-SAs/AC. Kredit:GENG Jing I nyere forskning, forskere ledet af prof. Zhang Haimin fra Institute of Solid State Physics ved Hefei Institutes of
Ny katalysator bevist effektiv i elektrosyntese af ammoniakSkematisk illustration af den syntetiske proces af Mo-SAs/AC. Kredit:GENG Jing I nyere forskning, forskere ledet af prof. Zhang Haimin fra Institute of Solid State Physics ved Hefei Institutes of -
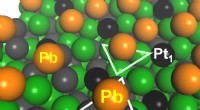 Ultrastabil, udviklet selektiv katalysator til propandehydrogeneringPå overfladen af den nyudviklede katalysator (PtGa-Pb/SiO2), Pt1-steder forbliver eksponerede for at lette katalytisk reaktion, mens Pt3-steder (og Ga3-steder) vist med trekanter blokeres af Pb. Kre
Ultrastabil, udviklet selektiv katalysator til propandehydrogeneringPå overfladen af den nyudviklede katalysator (PtGa-Pb/SiO2), Pt1-steder forbliver eksponerede for at lette katalytisk reaktion, mens Pt3-steder (og Ga3-steder) vist med trekanter blokeres af Pb. Kre
- Magnetiske materialer til fremtidens motorer
- Mexico siger, at truede marsvin døde i fangenskab
- Hvorfor hælder mennesket sine ressourcer ud i rummet?
- Ny undersøgelse afslører, hvordan brint gav energi ved livets oprindelse
- Sådan forhindrer du forstyrrelser i fødevareforsyningskæderne efter COVID-19
- DNA som usynligt blæk kan reversibelt skjule mønstre


