Hvis et overskud af nitrogen omsættes med 3,41 gram brint, hvor meget ammoniak kan der produceres?
$$N_2 + 3H_2 \højrepil 2NH_3$$
For at bestemme mængden af ammoniak, der kan produceres, skal vi først beregne antallet af tilgængelige mol brint. Den molære masse af hydrogen (H2) er 2,016 g/mol.
Antal mol brint =Masse af brint / Molær masse af brint
Antal mol brint =3,41 g / 2,016 g/mol
Antal mol brint =1,69 mol
Ifølge den afbalancerede kemiske ligning kræves der 3 mol brint for at producere 2 mol ammoniak. Derfor er antallet af mol ammoniak, der kan produceres:
Antal mol ammoniak =(2/3) * Antal mol brint
Antal mol ammoniak =(2/3) * 1,69 mol
Antal mol ammoniak =1,13 mol
Den molære masse af ammoniak (NH3) er 17,04 g/mol. Derfor er massen af ammoniak, der kan produceres:
Masse af ammoniak =Antal mol ammoniak * Molær masse af ammoniak
Masse af ammoniak =1,13 mol * 17,04 g/mol
Masse ammoniak =19,23 g
Derfor kan 3,41 gram brint producere op til 19,23 gram ammoniak.
 Varme artikler
Varme artikler
-
 Tilføjelse af endnu et lag metalfluorid kan forbedre solcellernes ydeevneBetydelige præstationsgevinster i tandemsolceller fra perovskit-silicium (såsom billedet ovenfor) kan opnås ved at tilføje et magnesiumfluorid-mellemlag. Kredit:2022 KAUST; Erkan Aydin Indsættelse
Tilføjelse af endnu et lag metalfluorid kan forbedre solcellernes ydeevneBetydelige præstationsgevinster i tandemsolceller fra perovskit-silicium (såsom billedet ovenfor) kan opnås ved at tilføje et magnesiumfluorid-mellemlag. Kredit:2022 KAUST; Erkan Aydin Indsættelse -
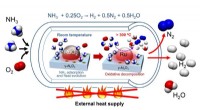 Opdagelse af en let proces til H2 -produktion ved hjælp af ammoniak som bærerH2 -produktion fra ammoniak og ilt udløses ved stuetemperatur uden ekstern varmeindgang. Kredit:Oita University Hydrogen (H2) har tiltrukket sig betydelig opmærksomhed som en ren energikilde, ford
Opdagelse af en let proces til H2 -produktion ved hjælp af ammoniak som bærerH2 -produktion fra ammoniak og ilt udløses ved stuetemperatur uden ekstern varmeindgang. Kredit:Oita University Hydrogen (H2) har tiltrukket sig betydelig opmærksomhed som en ren energikilde, ford -
 MOF'er kan registrere og sortere besværlige gasserDenne elektrode bruges til at indsamle MOFernes sanseegenskaber. Kredit:2019 KAUST Fra astronauter og ubåde til minearbejdere og redningsarbejdere, mennesker, der opererer i små, lukkede rum har b
MOF'er kan registrere og sortere besværlige gasserDenne elektrode bruges til at indsamle MOFernes sanseegenskaber. Kredit:2019 KAUST Fra astronauter og ubåde til minearbejdere og redningsarbejdere, mennesker, der opererer i små, lukkede rum har b -
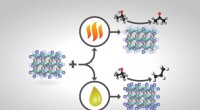 Forskere tilpasser katalysatorer for at øge produktudbyttet, reducere separationsomkostningerneHvordan perovskitkatalysatorer fremstilles og behandles ændrer deres overfladesammensætning og ultimative produktudbytte. Hvis visse perovskitkatalysatorer med formlen ABO3 varmebehandles, Katalysator
Forskere tilpasser katalysatorer for at øge produktudbyttet, reducere separationsomkostningerneHvordan perovskitkatalysatorer fremstilles og behandles ændrer deres overfladesammensætning og ultimative produktudbytte. Hvis visse perovskitkatalysatorer med formlen ABO3 varmebehandles, Katalysator
- Flow af flydende metaller fundet at udvise overraskende turbulens
- Kommer du ind på dit hotelværelse efter en nat i byen? Det kunne der være en app til
- Lande grupperer sig i klynger, efterhånden som COVID-19-udbruddet spreder sig
- Grafenforstærket kulfiber kan føre til overkommelige, stærkere bilmaterialer
- En sommer med læring, dybt i Costa Rica
- Sådan identificerer du edderkopper i South Carolina


