Damptrykket på 1 m NaCl er lavere end de 0,5 KNO3, forudsat at opløsningsmiddel i hvert tilfælde vand?
Van't Hoff-faktoren (i) er et mål for antallet af partikler, et stof dissocieres til, når det opløses i et opløsningsmiddel. For NaCl er i =2, fordi det dissocieres i Na+ og Cl- ioner. For KNO3 er i =2, fordi det dissocieres i K+ og NO3- ioner.
En opløsnings kogepunktsstigning og frysepunktssænkning er begge kolligative egenskaber, hvilket betyder, at de afhænger af antallet af partikler i en opløsning frem for deres kemiske natur. Kogepunktshøjden (∆Tb) og frysepunktsnedsættelsen (∆Tf) er givet ved følgende ligninger:
∆Tb =Kb * m * i
∆Tf =Kf * m * i
hvor Kb er kogepunktshøjdekonstanten, Kf er frysepunktsdepressionskonstanten, m er opløsningens molalitet (mol opløst stof pr. kilogram opløsningsmiddel), og i er van't Hoff-faktoren.
Da 1 m NaCl har en højere van't Hoff-faktor end 0,5 m KNO3, vil det forårsage en større kogepunktsforhøjelse og frysepunktssænkning. Derfor vil damptrykket på 1 m NaCl være lavere end på 0,5 m KNO3.
Sammenfattende er udsagnet om, at damptrykket på 1 m NaCl er lavere end 0,5 m KNO3, forkert. Damptrykket på 1 m NaCl vil faktisk være højere på grund af dets højere van't Hoff-faktor.
 Varme artikler
Varme artikler
-
 Avanceret kræftlægemiddel krymper og interkalerer DNAKræftcelle under celledeling. Kredit:National Institutes of Health På grund af de skadelige bivirkninger af kemoterapi, og den stigende resistens over for lægemidler, der findes i mange kræftcelle
Avanceret kræftlægemiddel krymper og interkalerer DNAKræftcelle under celledeling. Kredit:National Institutes of Health På grund af de skadelige bivirkninger af kemoterapi, og den stigende resistens over for lægemidler, der findes i mange kræftcelle -
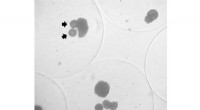 Små lægemiddelleverende kapsler kunne opretholde transplanterede insulinproducerende cellerPancreas-øceller indkapslet sammen med mikrosfærer, der frigiver et lægemiddel, der øger levedygtigheden i miljøer med lavt iltindhold. Mikrosfærerne har pile, der peger på dem; de større klatter er c
Små lægemiddelleverende kapsler kunne opretholde transplanterede insulinproducerende cellerPancreas-øceller indkapslet sammen med mikrosfærer, der frigiver et lægemiddel, der øger levedygtigheden i miljøer med lavt iltindhold. Mikrosfærerne har pile, der peger på dem; de større klatter er c -
 Sådan bliver en badesvamp til et biobaseret industrielt filterProfessor Hermann Ehrlich ser på et stykke af det nye materiale. Kredit:TU Bergakademie Freiberg / C. Mokry Forskere ved TU Bergakademie Freiberg udviklede et innovativt materiale fra en dyrket ma
Sådan bliver en badesvamp til et biobaseret industrielt filterProfessor Hermann Ehrlich ser på et stykke af det nye materiale. Kredit:TU Bergakademie Freiberg / C. Mokry Forskere ved TU Bergakademie Freiberg udviklede et innovativt materiale fra en dyrket ma -
 Stort dipolmoment induceret bredspektret bismuthchromat for effektiv fotokatalytisk ydeevne(a) sammenligning af fotokatalytisk vandoxidationsaktivitet med forskellige fotokatalysatorer og (b) den bølgelængdeafhængige AQE af vandoxidation over Bi 8 (CrO 4 ) O 11 . (c) sammenligning af
Stort dipolmoment induceret bredspektret bismuthchromat for effektiv fotokatalytisk ydeevne(a) sammenligning af fotokatalytisk vandoxidationsaktivitet med forskellige fotokatalysatorer og (b) den bølgelængdeafhængige AQE af vandoxidation over Bi 8 (CrO 4 ) O 11 . (c) sammenligning af
- Hvordan solprominenser vibrerer
- Hvilket af følgende ville forårsage en fejl i DNA-replikation?
- Går ud over menneskelige fejl
- Biden underskriver $280B. CHIPS i et forsøg på at styrke USA over Kina
- Great Barrier Reef er udsat for en massiv koralblegning
- Har vi ændret vores veje efter BP-olieudslippet? Ikke rigtig


