Vil en øget temperatur og koncentration fremskynde en kemisk reaktion?
Tilsvarende øger koncentrationen af reaktanter chancerne for kollisioner mellem partikler, hvilket fører til en højere sandsynlighed for vellykkede reaktioner. Det er dog værd at bemærke, at stigende koncentration muligvis ikke altid resulterer i en lineær stigning i reaktionshastigheden på grund af faktorer såsom nedsat overfladeareal i koncentrerede opløsninger eller dannelsen af hæmmende biprodukter.
Der kan være undtagelser fra denne generelle regel. For eksempel kan ekstremt høje temperaturer eller meget høje reaktantkoncentrationer i nogle tilfælde føre til sidereaktioner eller nedbrydning, som kan bremse eller ændre den ønskede kemiske reaktion. Derfor er det vigtigt at overveje de specifikke reaktionsbetingelser, mekanismer og potentielle begrænsninger, før du foretager forudsigelser om virkningerne af temperatur- og koncentrationsændringer.
 Varme artikler
Varme artikler
-
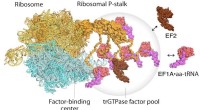 Højhastigheds atomkraftmikroskopi visualiserer celleproteinfabrikkerModel til oversættelse af ribosomer og forlængelsesfaktorer. EF1A • GTP • aatRNA og EF2 samles til den ribosomale stilk på det translaterende ribosom. Oversættelsesfaktorpuljen bidrager til effektiv p
Højhastigheds atomkraftmikroskopi visualiserer celleproteinfabrikkerModel til oversættelse af ribosomer og forlængelsesfaktorer. EF1A • GTP • aatRNA og EF2 samles til den ribosomale stilk på det translaterende ribosom. Oversættelsesfaktorpuljen bidrager til effektiv p -
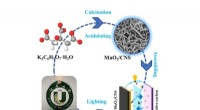 Carbon nanoark som en kompetent assistent til mangandioxid viser bemærkelsesværdig ydeevne i super…Kredit:Higher Education Press I forbindelse med kulstofneutralitet har superkondensatorer, som en ny grøn energilagringsenhed, vist fordele såsom hurtig opladning og afladning, høj effekttæthed og
Carbon nanoark som en kompetent assistent til mangandioxid viser bemærkelsesværdig ydeevne i super…Kredit:Higher Education Press I forbindelse med kulstofneutralitet har superkondensatorer, som en ny grøn energilagringsenhed, vist fordele såsom hurtig opladning og afladning, høj effekttæthed og -
 Pentacenderivat har 100 gange mere lysholdbarhed end konventionelle produkterLysustabilitet er en vigtig faktor, der forhindrer organiske halvledere i at blive implementeret. Forskere fra Osaka Metropolitan University demonstrerede, at den ultrahurtige intersystem-krydsning af
Pentacenderivat har 100 gange mere lysholdbarhed end konventionelle produkterLysustabilitet er en vigtig faktor, der forhindrer organiske halvledere i at blive implementeret. Forskere fra Osaka Metropolitan University demonstrerede, at den ultrahurtige intersystem-krydsning af -
 Cementfri beton slår korrosion og giver fatbergs skylEt fatberg udstillet i Melbourne Museum. Kredit:Copyright Museums Victoria, Fotograf:Rob Zugaro Forskere fra RMIT University har udviklet en miljøvenlig nul-cementbeton, hvilket næsten eliminerer
Cementfri beton slår korrosion og giver fatbergs skylEt fatberg udstillet i Melbourne Museum. Kredit:Copyright Museums Victoria, Fotograf:Rob Zugaro Forskere fra RMIT University har udviklet en miljøvenlig nul-cementbeton, hvilket næsten eliminerer
- Et kulstof kan danne enkelt- og dobbelttriplebindinger med hinanden, så hvorfor ikke en quadbinding…
- Hvad er en tempereret skov?
- Ingen problemer, tag din flyvetur, en robot parkerer din bil
- Hvordan påvirker relativ luftfugtighed, jeg føler mig udenfor?
- Unilever skal halvere brugen af ny plast
- Laksefarme er i krise – her er hvordan videnskabsmænd forsøger at redde dem


