Hvordan adskiller en binær forbindelse sig fra polyatomisk ion?
Komposition:
* Binære forbindelser indeholder kun to grundstoffer, mens polyatomiske ioner indeholder tre eller flere grundstoffer.
Debitering:
* Binære forbindelser bærer ikke en elektrisk ladning, mens polyatomiske ioner bærer en negativ eller positiv ladning.
Formation:
* Binære forbindelser dannes, når to grundstoffer reagerer kemisk og kombineres i et simpelt heltalsforhold. Omvendt dannes polyatomiske ioner, når en gruppe atomer binder sig sammen og får en ladning ved at miste eller få elektroner.
Stabilitet:
* Binære forbindelser er generelt mere stabile end polyatomære ioner.
Opløselighed:
* Opløseligheden af binære forbindelser og polyatomære ioner i vand og andre opløsningsmidler kan variere meget. Nogle binære forbindelser og polyatomiske ioner kan være opløselige, mens andre kan være uopløselige.
Ioniske vs. kovalente bindinger:
* Binære forbindelser kan dannes gennem ionisk eller kovalent binding, afhængigt af arten af de involverede elementer.
På den anden side holdes de fleste polyatomiske ioner sammen af kovalente bindinger, selvom de udviser ionbinding med de arter, de reagerer med for at danne forbindelser.
Polyatomiske ioner opfører sig som enkelte enheder i kemiske forbindelser og deltager i ionbinding eller kovalent binding som helhed, hvilket bidrager med deres kollektive ladning til forbindelsens samlede elektriske neutralitet.
Eksempler på binære forbindelser omfatter vand (H2O), kuldioxid (CO2) og natriumchlorid (NaCl). Eksempler på polyatomære ioner omfatter hydroxid (OH⁻), carbonat (CO3²⁻) og ammonium (NH4⁺).
Sidste artikelHvorfor er vand så let forurenet?
Næste artikelGeovidenskab Hvilke gasser i atmosfæren er drivhusgas og hvilke ikke?
 Varme artikler
Varme artikler
-
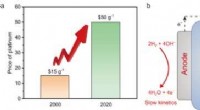 Billige legeringer konkurrerer med dyrt platin for at booste brændselscellerDen venstre figur viser platinpristendenserne over de seneste to årtier, og den højre figur forklarer alternativet:anionbyttermembranbrændselsceller (AEMFCer). Kredit:QIN Shuai et al. Som den rene
Billige legeringer konkurrerer med dyrt platin for at booste brændselscellerDen venstre figur viser platinpristendenserne over de seneste to årtier, og den højre figur forklarer alternativet:anionbyttermembranbrændselsceller (AEMFCer). Kredit:QIN Shuai et al. Som den rene -
 Formskiftende middel er rettet mod skadelige bakterier i mavenKredit:University of Illinois i Urbana-Champaign En ny formskiftende polymer kan målrette og dræbe Helicobacter pylori-bakterier i maven uden at dræbe nyttige bakterier i tarmen. En sådan behandli
Formskiftende middel er rettet mod skadelige bakterier i mavenKredit:University of Illinois i Urbana-Champaign En ny formskiftende polymer kan målrette og dræbe Helicobacter pylori-bakterier i maven uden at dræbe nyttige bakterier i tarmen. En sådan behandli -
 Carbon black genanvendes fra bildækTop, primærprodukt fra venstre til højre:rå rCB, ren rCB (96+), ren rCB med perler (96+). Bund, sekundære produkter genvundet fra asken, fra venstre til højre:flydende natriumsilicat eller vandglas, u
Carbon black genanvendes fra bildækTop, primærprodukt fra venstre til højre:rå rCB, ren rCB (96+), ren rCB med perler (96+). Bund, sekundære produkter genvundet fra asken, fra venstre til højre:flydende natriumsilicat eller vandglas, u -
 At lave rent brint er svært, men forskere har lige løst en stor forhindringHoldets eksperimentelle vandopdelingsapparat. Kredit:Cockrell School of Engineering, University of Texas i Austin I årtier, forskere rundt om i verden har søgt efter måder at bruge solenergi til a
At lave rent brint er svært, men forskere har lige løst en stor forhindringHoldets eksperimentelle vandopdelingsapparat. Kredit:Cockrell School of Engineering, University of Texas i Austin I årtier, forskere rundt om i verden har søgt efter måder at bruge solenergi til a
- Videnskaben omkring planeten bruger billeder af Jorden fra rumstationen
- Model analyserer, hvordan vira undslipper immunsystemet
- Hvilken genstand er den type stof, der udgør og er arrangeret?
- Hvem opfandt sporken?
- Hvad er mitokondriers funktion i eukayotiske organismer?
- Hvilke kovalente bindinger er mest polære?


