Hvad er betydningen af ioniseringstilstand for at bestemme et stofs kemiske egenskaber?
1. Reaktivitet: Ioniseringstilstand har direkte indflydelse på et stofs reaktivitet. Grundstoffer eller forbindelser med forskellige ioniseringstilstande har forskelligt antal valenselektroner, som er de yderste elektroner, der deltager i kemiske reaktioner. Grundstoffer med flere valenselektroner har en tendens til at være mere reaktive, mens dem med færre valenselektroner er mindre reaktive.
2. Ionisk binding: Ioniseringstilstanden bestemmer, om et atom kan danne ionbindinger eller kovalente bindinger. Ionbinding opstår, når et atom donerer elektroner til et andet atom, hvilket skaber positivt ladede ioner (kationer) og negativt ladede ioner (anioner). Grundstoffer med væsentligt forskellige ioniseringsenergier har tendens til at danne ioniske forbindelser.
3. Kovalent binding: Grundstoffer med lignende ioniseringsenergier kan danne kovalente bindinger, der deler elektronpar for at opnå en mere stabil elektronkonfiguration. Kovalent binding er almindelig blandt ikke-metaller og grundstoffer inden for samme gruppe i det periodiske system.
4. Metallisk binding: Metaller har lav ioniseringsenergi, hvilket betyder, at de let kan miste valenselektroner. Denne egenskab tillader metalatomer at danne et "hav" af mobile elektroner, der er delokaliseret gennem metalgitteret. Dette elektronhav giver metaller deres karakteristiske egenskaber, såsom høj elektrisk og termisk ledningsevne, formbarhed og duktilitet.
5. Opløselighed: Ioniseringstilstand påvirker opløseligheden af forbindelser i forskellige opløsningsmidler. Ioniske forbindelser har en tendens til at være mere opløselige i polære opløsningsmidler som vand, hvor ionerne kan interagere med opløsningsmiddelmolekylerne gennem elektrostatiske kræfter. Kovalente forbindelser er på den anden side normalt mere opløselige i ikke-polære opløsningsmidler, hvor de oplever svagere intermolekylære kræfter.
6. Syre-base-egenskaber: Ioniseringstilstand er afgørende for at bestemme stoffernes syre-base egenskaber. Syrer er stoffer, der kan donere protoner (H+), mens baser er stoffer, der kan modtage protoner. Ioniseringstilstanden af de funktionelle grupper i en forbindelse påvirker dens evne til at donere eller acceptere protoner og bestemmer dermed dens sure eller basiske karakter.
7. Magnetiske egenskaber: Ioniseringstilstanden af overgangsmetalioner påvirker deres magnetiske egenskaber. Uparrede elektroner i d-orbitaler af overgangsmetalioner bidrager til ionens magnetiske moment. Antallet af uparrede elektroner afhænger af ioniseringstilstanden og krystalfeltopdelingen af d orbitaler.
Sammenfattende styrer ioniseringstilstand forskellige kemiske egenskaber af stoffer, herunder reaktivitet, bindingsadfærd, opløselighed, syre-base egenskaber og magnetiske egenskaber. Forståelse af ioniseringstilstande af grundstoffer og forbindelser gør det muligt for kemikere at forudsige og forklare deres kemiske adfærd og designe materialer med specifikke egenskaber til forskellige anvendelser.
 Varme artikler
Varme artikler
-
 Nye bionedbrydelige polyurethanskum er udviklet af hvedestråKredit:CC0 Public Domain Hvert år produceres omkring 734 millioner tons hvedestrå på verdensplan, en stor mængde affald, som er billig og ikke har haft nogen veldefineret brug indtil nu. For nylig
Nye bionedbrydelige polyurethanskum er udviklet af hvedestråKredit:CC0 Public Domain Hvert år produceres omkring 734 millioner tons hvedestrå på verdensplan, en stor mængde affald, som er billig og ikke har haft nogen veldefineret brug indtil nu. For nylig -
 Ny effektiv metode til urinanalyse kan fortælle os mereBrug af gadolinium (kontrastmiddel brugt i MR-scanninger) kan revolutionere anvendelsen af nuklear magnetisk resonansspektroskopi som et værktøj til mere omfattende og nyttig analyse af urinprøver.
Ny effektiv metode til urinanalyse kan fortælle os mereBrug af gadolinium (kontrastmiddel brugt i MR-scanninger) kan revolutionere anvendelsen af nuklear magnetisk resonansspektroskopi som et værktøj til mere omfattende og nyttig analyse af urinprøver. -
 Varmbrygget kaffe har højere niveauer af antioxidanter end koldtbryggetUndersøgelsesforfattere Megan Fuller (højre) og Niny Rao (venstre), fakultet ved Jefferson (Philadelphia University + Thomas Jefferson University) Kredit:Jefferson (Philadelphia University + Thomas Je
Varmbrygget kaffe har højere niveauer af antioxidanter end koldtbryggetUndersøgelsesforfattere Megan Fuller (højre) og Niny Rao (venstre), fakultet ved Jefferson (Philadelphia University + Thomas Jefferson University) Kredit:Jefferson (Philadelphia University + Thomas Je -
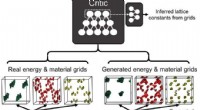 Omvendt design af porøse materialer ved hjælp af kunstige neurale netværkOverordnede skemaer af ZeoGAN. Energi (grøn) refererer i dette tilfælde til potentiel metanenergi, og materialegitter angiver silicium (rød) og oxygen (gule) atomer. Kredit:Science Advances, doi:10.11
Omvendt design af porøse materialer ved hjælp af kunstige neurale netværkOverordnede skemaer af ZeoGAN. Energi (grøn) refererer i dette tilfælde til potentiel metanenergi, og materialegitter angiver silicium (rød) og oxygen (gule) atomer. Kredit:Science Advances, doi:10.11
- Forskere ved nu, hvorfor du nogle gange føler dig synsk
- Diversitet øger kun marginalt nøjagtigheden af gruppens forudsigelser
- Nyt potent antimikrobielt middel fra termofil bakterie
- Den russiske teknologigigant gør håb om en smartphone
- Snefaldsmønstre kan give spor til Grønlands Indlandsis
- Fleksibel tænkning på silicium solceller


