At reducere temperaturen på en reaktion falder?
* reaktionshastighed: Lavere temperaturer betyder, at molekyler har mindre kinetisk energi, hvilket fører til færre kollisioner og mindre vellykkede kollisioner med nok energi til at overvinde aktiveringsenergibarrieren.
* ligevægtskonstant (K) for eksoterme reaktioner: For eksotermiske reaktioner skifter nedsættelse af temperaturen ligevægten for at favorisere dannelsen af flere reaktanter. Dette skyldes, at reaktionen frigiver varme, og at sænke temperaturen får systemet til at generere mere varme for at nå ligevægt.
* hastighedskonstant (k): Hastighedskonstanten er en proportionalitetskonstant, der relaterer hastigheden for en reaktion på koncentrationerne af reaktanter. Lavere temperaturer resulterer i en lavere hastighedskonstant, hvilket betyder, at reaktionen fortsætter langsommere.
Det er dog vigtigt at bemærke, at:
* Effekten på ligevægtskonstant for endotermiske reaktioner er det modsatte: For endotermiske reaktioner skifter nedsættelse af temperaturen ligevægten for at favorisere dannelsen af flere produkter.
* Ikke alle reaktioner påvirkes lige: Nogle reaktioner er mere følsomme over for temperaturændringer end andre.
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse punkter!
 Varme artikler
Varme artikler
-
 Forskere gør plastforurening til rengøringsmidlerKredit:CC0 Public Domain Forskere ved University of Bristol har opdaget en måde at genbruge en almindelig plast til at nedbryde skadelige farvestoffer i vores spildevand. Papiret offentliggjort i
Forskere gør plastforurening til rengøringsmidlerKredit:CC0 Public Domain Forskere ved University of Bristol har opdaget en måde at genbruge en almindelig plast til at nedbryde skadelige farvestoffer i vores spildevand. Papiret offentliggjort i -
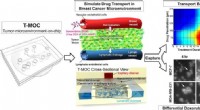 Mikrofluidisk anordning simulerer kræftbehandling lige så effektivt som forskningsdyrDenne grafik viser, hvordan en ny teknologi udviklet på Purdue University, der simulerer tumorer. Kredit:Purdue University foto/Altug Ozcelikkale En ny teknologi, der simulerer tumorer, har vist s
Mikrofluidisk anordning simulerer kræftbehandling lige så effektivt som forskningsdyrDenne grafik viser, hvordan en ny teknologi udviklet på Purdue University, der simulerer tumorer. Kredit:Purdue University foto/Altug Ozcelikkale En ny teknologi, der simulerer tumorer, har vist s -
 Forskere udvikler molekylært termometer til kontaktløs måling ved hjælp af infrarødt lysDen molekylære rubin i fast (rød) og opløst (gul) tilstand kan bruges til kontaktløs måling af temperatur. Kredit:Sven Otto, JGU Kemikere ved Johannes Gutenberg University Mainz (JGU) har i samarb
Forskere udvikler molekylært termometer til kontaktløs måling ved hjælp af infrarødt lysDen molekylære rubin i fast (rød) og opløst (gul) tilstand kan bruges til kontaktløs måling af temperatur. Kredit:Sven Otto, JGU Kemikere ved Johannes Gutenberg University Mainz (JGU) har i samarb -
 Supercomputing mere lys end varmeMaverick-supercomputersystemet ved Texas Advanced Computing Center. Maverick er en XSEDE-allokeret dedikeret visualiserings- og dataanalyseressource bygget med 132 NVIDIA Tesla K40 Atlas GPU til fjern
Supercomputing mere lys end varmeMaverick-supercomputersystemet ved Texas Advanced Computing Center. Maverick er en XSEDE-allokeret dedikeret visualiserings- og dataanalyseressource bygget med 132 NVIDIA Tesla K40 Atlas GPU til fjern
- Høje magnetiske felter styrer både hastighed og produkt af kemiske reaktioner
- Sådan fungerer militære snigskytter
- Hvad er to vigtige samfund af Nortwest -teritorier?
- Brug af lys til præcist at kontrollere enkelt-molekyle enheder
- I Egypten, arkæologer finder en del af 4, 000 år gammel statue
- Effekt af hastighedsmedium på lyd?


