Hvad er virkningen af temperatur på reaktioner på hastigheder?
Generelt princip:
* Forøget temperatur fører generelt til en hurtigere reaktionshastighed. Dette skyldes kollisionsteorien og aktiveringsenergi begreb.
Kollisionsteori:
* Forøget temperatur betyder, at molekyler har mere kinetisk energi. De bevæger sig hurtigere og kolliderer oftere.
* Flere kollisioner betyder flere chancer for effektive kollisioner Det førte til dannelse af produkter.
Aktiveringsenergi:
* aktiveringsenergi er den minimale energi, der kræves for reaktanter til at kollidere effektivt og danne produkter.
* Højere temperaturer giver flere molekyler nok energi til at overvinde aktiveringsenergibarrieren. Dette betyder, at flere molekyler reagerer, hvilket fører til en hurtigere hastighed.
Kvantitativt forhold:
* Forholdet mellem temperatur og hastighed er ofte beskrevet af Arrhenius -ligningen:
`` `
k =a * exp (-ea / rt)
`` `
* k: Hastighedskonstant (proportional med reaktionshastighed)
* a: Pre-eksponentiel faktor (relateret til kollisionsfrekvens)
* ea: Aktiveringsenergi
* r: Gas konstant
* t: Temperatur (i Kelvin)
* Denne ligning viser, at hastighedskonstanten (og dermed hastigheden) øges eksponentielt med temperaturen.
Andre overvejelser:
* Ikke alle reaktioner accelereres ved temperatur. Nogle reaktioner er eksoterme og kan blive bremset med høje temperaturer.
* Effekten af temperatur kan variere markant afhængigt af den specifikke reaktion. Nogle reaktioner er meget følsomme over for temperaturændringer, mens andre er mindre.
Eksempler:
* Madlavning: Fødevarekoger hurtigere ved højere temperaturer, fordi de kemiske reaktioner, der er involveret i nedbrydning af fødevaremolekylerne, accelereres.
* Rusting: Rusting (oxidation af jern) er hurtigere i varme, fugtige miljøer, fordi temperaturen og fugt fremmer reaktionen.
* Eksplosioner: Eksplosioner involverer ofte reaktioner, der er ekstremt følsomme over for temperatur og kan fortsætte meget hurtigt ved høje temperaturer.
Sammenfattende er temperaturen en afgørende faktor, der påvirker reaktionshastighederne. Højere temperaturer fører generelt til hurtigere reaktioner på grund af øget molekylær bevægelse, flere kollisioner og en større brøkdel af molekyler, der overskrider aktiveringsenergibarrieren.
Sidste artikelAt reducere temperaturen på en reaktion falder?
Næste artikelEr reaktionstid og temperatur direkte proportional?
 Varme artikler
Varme artikler
-
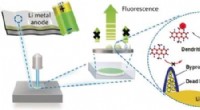 Fluorescensprobe viser fordelingen af aktive lithiumarter på lithiummetalanoderKredit:Wiley Batterier med metalliske lithium-anoder giver forbedret effektivitet sammenlignet med konventionelle lithium-ion-batterier på grund af deres højere kapacitet. Imidlertid, sikkerhedshe
Fluorescensprobe viser fordelingen af aktive lithiumarter på lithiummetalanoderKredit:Wiley Batterier med metalliske lithium-anoder giver forbedret effektivitet sammenlignet med konventionelle lithium-ion-batterier på grund af deres højere kapacitet. Imidlertid, sikkerhedshe -
 Elektronbevægelser i væske målt i super-slowmotionForskerne sprøjter vand fra oven ind i analysekammeret, hvor den danner en kort mikrojet, der møder en laserstråle. Kredit:ETH Zürich / Inga Jordan Elektroner er i stand til at bevæge sig inden fo
Elektronbevægelser i væske målt i super-slowmotionForskerne sprøjter vand fra oven ind i analysekammeret, hvor den danner en kort mikrojet, der møder en laserstråle. Kredit:ETH Zürich / Inga Jordan Elektroner er i stand til at bevæge sig inden fo -
 Tågeharpe øger opsamlingskapaciteten for rent vandUndersøgelsesforfatter Josh Tulkoff konstruerer en stor prototype af tågeharpen, som består af et lodret array på 700 ledninger og er baseret på første eksperimentelle resultater. Tulkoff var en del a
Tågeharpe øger opsamlingskapaciteten for rent vandUndersøgelsesforfatter Josh Tulkoff konstruerer en stor prototype af tågeharpen, som består af et lodret array på 700 ledninger og er baseret på første eksperimentelle resultater. Tulkoff var en del a -
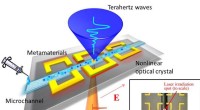 Mikroanalyse af biologiske prøver til tidlig sygdomsdetektionFig.1. En skematisk tegning af opløsningsmåling ved hjælp af fremstillet terahertz mikrofluidisk chip. Chippen består af en lokal THz-strålingspunktkilde, en enkelt mikrokanal og nogle få arrays af sp
Mikroanalyse af biologiske prøver til tidlig sygdomsdetektionFig.1. En skematisk tegning af opløsningsmåling ved hjælp af fremstillet terahertz mikrofluidisk chip. Chippen består af en lokal THz-strålingspunktkilde, en enkelt mikrokanal og nogle få arrays af sp
- Comcast lover energieffektivitetsforbedringer for sit enorme kabel- og internetsystem
- Det østlige Kina udpeges som kilde til slyngelstatiske ozonnedbrydende emissioner
- Republikanerne mere overbevisende end forskere om klimaændringer
- Hvad er meningen med naturen ved bedst?
- Sådan laver du papemaskiner
- Hvilken type hvirveldyr er elefanten?


