Er reaktionstid og temperatur direkte proportional?
* øget temperatur, hurtigere reaktioner: Højere temperaturer fører generelt til hurtigere reaktionshastigheder. Dette skyldes, at varme giver mere energi til molekylerne, hvilket øger hyppigheden af kollisioner og sandsynligheden for vellykkede kollisioner, der fører til reaktioner.
* Arrhenius ligning: Denne ligning beskriver matematisk forholdet mellem temperatur og reaktionshastighed. Det viser, at hastighedskonstanten (k) øges eksponentielt med temperaturen. Forholdet er imidlertid ikke lineært, og det afhænger af reaktionens aktiveringsenergi.
* Andre faktorer: Temperaturen er ikke den eneste faktor, der påvirker reaktionshastigheden. Andre vigtige faktorer inkluderer:
* koncentration af reaktanter: Højere koncentrationer fører til hurtigere satser.
* overfladeareal af faste stoffer: Øget overfladeareal for faste stoffer øger reaktionshastigheden.
* tilstedeværelse af katalysatorer: Katalysatorer fremskynder reaktioner uden at blive konsumeret.
Eksempel:
Forestil dig at lave et måltid. Hvis du koger det ved en højere temperatur, koges den hurtigere. Imidlertid vil fordobling af temperaturen ikke nødvendigvis fordoble tilberedningstiden. Forholdet er mere komplekst og påvirket af andre faktorer.
Kortfattet:
Mens højere temperaturer generelt fører til hurtigere reaktionshastigheder, er forholdet ikke direkte proportionalt. Arrhenius -ligningen og andre faktorer spiller en rolle i bestemmelsen af det nøjagtige forhold mellem temperatur og reaktionstid.
 Varme artikler
Varme artikler
-
 Tweaks bag genfødslen af næsten kasserede organiske solteknologierUdvælgelse af solceller i laboratoriet hos GTRI Principal Research Engineer Jud Ready. Cellerne inkluderer 3D, CZTS, organisk solcelle, og silicium. Kredit:Georgia Tech/Branden Camp Et solenergima
Tweaks bag genfødslen af næsten kasserede organiske solteknologierUdvælgelse af solceller i laboratoriet hos GTRI Principal Research Engineer Jud Ready. Cellerne inkluderer 3D, CZTS, organisk solcelle, og silicium. Kredit:Georgia Tech/Branden Camp Et solenergima -
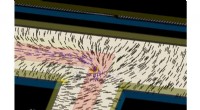 Aktive flydende krystalsystemer undersøgt i jagten på autonome materialesystemerSimuleringsøjebliksbillede af en selvkørende topologisk defekt i en aktiv flydende krystal styret af et lysmønster (skinnede i lyserødt område). Kredit:Prof. Zhang Rui, HKUST Liquid Crystals (LC)
Aktive flydende krystalsystemer undersøgt i jagten på autonome materialesystemerSimuleringsøjebliksbillede af en selvkørende topologisk defekt i en aktiv flydende krystal styret af et lysmønster (skinnede i lyserødt område). Kredit:Prof. Zhang Rui, HKUST Liquid Crystals (LC) -
 Levende elektroder med bakterier og organisk elektronikGábor Méhes, forsker ved Linköpings Universitet. Fotokredit Thor Balkhed Forskere ved Laboratory of Organic Electronics, Linköpings Universitet, har sammen med kolleger ved Lawrence Berkeley Natio
Levende elektroder med bakterier og organisk elektronikGábor Méhes, forsker ved Linköpings Universitet. Fotokredit Thor Balkhed Forskere ved Laboratory of Organic Electronics, Linköpings Universitet, har sammen med kolleger ved Lawrence Berkeley Natio -
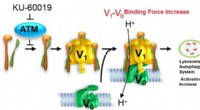 Forskere rapporterer hæmning af cellulær aldringOpdag nøglen til at afsløre hemmeligheden bag reversibel aldringsopsving. Kredit:DGIST Aldring er en forringelse af en celles evne til at dele sig og vokse, når den bliver ældre. Dette forårsager
Forskere rapporterer hæmning af cellulær aldringOpdag nøglen til at afsløre hemmeligheden bag reversibel aldringsopsving. Kredit:DGIST Aldring er en forringelse af en celles evne til at dele sig og vokse, når den bliver ældre. Dette forårsager
- Iskolt landing:landingsbane åbner på frossen amerikansk sø
- Teknologidrømmen lever stadig ved TED-samling på trods af Facebook-debacle
- Har et af matematikkens største mysterier, Riemann-hypotesen, endelig blevet løst?
- Hvilken halvkugle er den tropiske af Stenbukken og Antarktis cirkel i?
- Ny hypotese:Hvorfor bakterier bliver mere og mere modstandsdygtige over for antibiotika
- Udforskning af, hvordan antibiotika trænger ind i gramnegative bakterielle cellevægge


