Hvilken effekt dosis temperatur har på reaktionshastigheden?
* øget temperatur =øget reaktionshastighed: Højere temperaturer fører generelt til hurtigere reaktionshastigheder. Dette er fordi:
* Øget kinetisk energi: Molekyler bevæger sig hurtigere ved højere temperaturer, hvilket fører til hyppigere kollisioner.
* øget kollisionsenergi: Disse kollisioner er mere energiske, hvilket gør det mere sandsynligt, at kollisionerne vil have nok energi til at overvinde aktiveringsenergibarriere og danne produkter.
* Arrhenius -ligningen: Denne ligning beskriver matematisk forholdet mellem temperatur og reaktionshastighed:
`` `
k =a * exp (-ea / (r * t))
`` `
Hvor:
* k er hastighedskonstanten (højere k betyder hurtigere reaktion)
* A er den præ-eksponentielle faktor (relateret til hyppigheden af kollisioner)
* EA er aktiveringsenergien (den minimale energi, der kræves til en reaktion)
* R er den ideelle gaskonstant
* T er den absolutte temperatur (i Kelvin)
* Undtagelser: Mens temperaturen generelt øger reaktionshastighederne, er der nogle undtagelser:
* ligevægtsreaktioner: For reaktioner, der når ligevægt, kan stigende temperatur muligvis skifte ligevægt mod reaktanter eller produkter, afhængigt af om reaktionen er eksoterm eller endoterm.
* komplekse reaktioner: I multi-trins reaktioner kan stigende temperatur påvirke forskellige trin forskelligt, hvilket potentielt kan føre til et mere komplekst resultat.
Kortfattet:
* Højere temperaturer fører generelt til hurtigere reaktioner på grund af øget kinetisk energi og kollisionsfrekvens.
* Arrhenius -ligningen beskriver dette forhold matematisk.
* Der er nogle undtagelser fra denne generelle regel, især i ligevægtsreaktioner og komplekse reaktioner.
Sidste artikelEr reaktionstid og temperatur direkte proportional?
Næste artikelJohn Atomic Theory sagde, at atomer af det samme?
 Varme artikler
Varme artikler
-
 Forskere opdager protonregulator af essentielt kræftmicroRNAKredit:CC0 Public Domain MicroRNAer (miRNAer) er evolutionært bevarede små ikke -kodende RNAer - bits af genetisk kode, der fungerer som kritiske genregulatorer i mange aspekter af biologiske proc
Forskere opdager protonregulator af essentielt kræftmicroRNAKredit:CC0 Public Domain MicroRNAer (miRNAer) er evolutionært bevarede små ikke -kodende RNAer - bits af genetisk kode, der fungerer som kritiske genregulatorer i mange aspekter af biologiske proc -
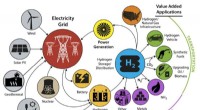 Forskere stræber efter lave omkostninger, effektive teknologier til brintproduktionKredit:US Department of Energy Mens brint ofte omtales som fremtidens forureningsfrie brændstof, især til brug i brændselscelle elektriske køretøjer, brint kan bruges til meget mere end nul-emissi
Forskere stræber efter lave omkostninger, effektive teknologier til brintproduktionKredit:US Department of Energy Mens brint ofte omtales som fremtidens forureningsfrie brændstof, især til brug i brændselscelle elektriske køretøjer, brint kan bruges til meget mere end nul-emissi -
 Tynd hud:Japansk firma udvikler ultrafin spray-on ansigtsmaskeFirmaet hævder, at den anden hud er unik Et japansk kosmetikfirma afslørede onsdag, hvad det sagde var verdens første spray-on hud, en fugtgivende ansigtsmaske lavet af fibre, der er en hundredede
Tynd hud:Japansk firma udvikler ultrafin spray-on ansigtsmaskeFirmaet hævder, at den anden hud er unik Et japansk kosmetikfirma afslørede onsdag, hvad det sagde var verdens første spray-on hud, en fugtgivende ansigtsmaske lavet af fibre, der er en hundredede -
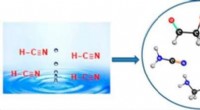 Ny indsigt i livets oprindelseKredit:American Chemical Society Et berømt forsøg i 1953 viste, at aminosyrer, byggestenene i proteiner, kunne have dannet sig spontant under de atmosfæriske forhold på den tidlige Jord. Imidlerti
Ny indsigt i livets oprindelseKredit:American Chemical Society Et berømt forsøg i 1953 viste, at aminosyrer, byggestenene i proteiner, kunne have dannet sig spontant under de atmosfæriske forhold på den tidlige Jord. Imidlerti
- Blandes Atlanterhavet og Stillehavet?
- Forskere udvikler mikro-elektro-fluidisk probe (MeFP) til at isolere og mønstre celler
- Et effektivt numerisk program til at studere lysspredning på nanoskala
- Hvor stor er svovlprocenten i chalcopyrit?
- Forklar hvad der bestemmer viskositeten af en væske?
- Sådan laver du sjette klasse matematikforholdstabeller


