Hvorfor er der behov for mere varme for at fordampe vand end benzin?
1. Stærkere intermolekylære kræfter:
* vand (H₂O): Vandmolekyler er meget polære, hvilket betyder, at de har en positiv og negativ ende på grund af ujævn elektrondeling. Denne polaritet fører til stærke brintbindinger mellem vandmolekyler, som kræver en masse energi for at bryde.
* benzin: Benzin er en blanding af kulbrinter, som for det meste er ikke -polære. De intermolekylære kræfter mellem benzinmolekyler er svagere, primært van der Waals -kræfter.
2. Fordampningsvarme:
* fordampningsvarme er den mængde energi, der er nødvendig for at ændre et stof fra en væske til en gas ved dets kogepunkt.
* Vand har en signifikant højere fordampningsvarme (40,7 kJ/mol) end benzin (ca. 30 kJ/mol). Dette betyder, at det kræver mere energi at bryde brintbindingerne i vand og give molekylerne mulighed for at flygte ind i gasfasen.
Kortfattet:
De stærke hydrogenbindinger mellem vandmolekyler kræver et større input af energi (varme) for at overvinde sammenlignet med de svagere intermolekylære kræfter i benzin. Dette resulterer i, at vand har en højere fordampningsvarme, hvilket betyder, at der er behov for mere energi for at fordampe det.
Sidste artikelHvad er P4 i videnskab?
Næste artikel10 ting, der ikke opløses i vand?
 Varme artikler
Varme artikler
-
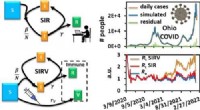 Kemi-laboratoriestuderende forudsiger spredning af COVID-19 med kinetikmodellerI denne graf forudsagde studerende i forårets kinetiklaboratorium daglige tilfælde i staten Ohio til efteråret 2022. Kredit:Ohio University Kemiker Jixin Chen så på den hurtige spredning af COVID-1
Kemi-laboratoriestuderende forudsiger spredning af COVID-19 med kinetikmodellerI denne graf forudsagde studerende i forårets kinetiklaboratorium daglige tilfælde i staten Ohio til efteråret 2022. Kredit:Ohio University Kemiker Jixin Chen så på den hurtige spredning af COVID-1 -
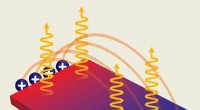 Exciplex-emission observeret over meget længere afstande end tidligere antaget muligtFigur 1:En langdistance-interaktion mellem elektroner (røde kugler) og huller (blå kugler) adskilt af en spacer giver anledning til exciplex-emission (orange kruseduller), der kunne bruges i effektive
Exciplex-emission observeret over meget længere afstande end tidligere antaget muligtFigur 1:En langdistance-interaktion mellem elektroner (røde kugler) og huller (blå kugler) adskilt af en spacer giver anledning til exciplex-emission (orange kruseduller), der kunne bruges i effektive -
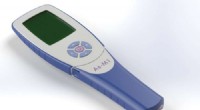 Enkel arsenføler kan redde livPrototypen arsenik sensor. Kredit:Bio Nano Consulting En lavpris, brugervenlig sensor, der kan teste drikkevand for arsen på bare et minut, er blevet udviklet af Imperial- og UCL-forskere. I hele
Enkel arsenføler kan redde livPrototypen arsenik sensor. Kredit:Bio Nano Consulting En lavpris, brugervenlig sensor, der kan teste drikkevand for arsen på bare et minut, er blevet udviklet af Imperial- og UCL-forskere. I hele -
 Kationtypers effekt på de elektrokrome egenskaber af titaniumdioxid nanokrystallerForskere fra Guangxi Universitet afslørede effekten af kationtyper på elektrokrome egenskaber af titaniumdioxid nanokrystaller. Kredit:Yi Liang, Guangxi University Elektrokrome (EC) enheder er bl
Kationtypers effekt på de elektrokrome egenskaber af titaniumdioxid nanokrystallerForskere fra Guangxi Universitet afslørede effekten af kationtyper på elektrokrome egenskaber af titaniumdioxid nanokrystaller. Kredit:Yi Liang, Guangxi University Elektrokrome (EC) enheder er bl


