Hvordan beskrives kemiske reaktioner?
1. Kemiske ligninger:
* Den mest basale beskrivelse: Dette bruger kemiske formler til at repræsentere reaktanterne (udgangsmaterialer) og produkter (resulterende stoffer).
* format: Reaktanter -> produkter
* Eksempel: 2H₂ + O₂ -> 2H₂O (brintgas reagerer med iltgas for at danne vand)
* leverer: Identiteterne af de involverede stoffer og deres støkiometriske forhold (relative mængder).
2. Reaktionsmekanismer:
* Detaljeret trin-for-trin-konto: Forklarer, hvordan en reaktion fortsætter, herunder dannelsen af mellemprodukter og de specifikke bindinger, der er brudt og dannet.
* ofte repræsenteret af: En række kemiske ligninger, der viser hvert enkelt trin.
* Eksempel: Forbrændingen af metan (CH₄) involverer en kompleks række trin med frie radikaler.
* leverer: En dybere forståelse af reaktionsprocessen, herunder det hastighedsbestemmende trin (langsomste trin) og overgangen stater.
3. Reaktionsbetingelser:
* beskriver miljøet: Inkluderer faktorer som temperatur, tryk, katalysator, opløsningsmiddel osv.
* Eksempel: Haber-Bosch-processen til ammoniaksyntese kræver højt tryk og temperatur.
* leverer: Væsentlig information til at forudsige, om der vil opstå en reaktion, og dens hastighed.
4. Termodynamik:
* bruger energikoncepter: Beskriver de energiændringer, der er involveret i en reaktion (entalpi, entropi, Gibbs fri energi).
* Eksempel: Eksotermiske reaktioner frigiver varme, mens endotermiske reaktioner absorberer varme.
* leverer: Oplysninger om spontaniteten af en reaktion og dens ligevægtskonstant.
5. Kinetik:
* fokuserer på reaktionshastigheder: Undersøger, hvor hurtigt en reaktion fortsætter, og hvordan den påvirkes af faktorer som koncentration, temperatur og overfladeareal.
* Eksempel: Hastighedsloven for en reaktion beskriver forholdet mellem reaktantkoncentrationer og reaktionshastigheden.
* leverer: Et kvantitativt mål for, hvor hurtigt en reaktion forekommer, og dens hastighedskonstant.
6. Reaktionstyper:
* klassificerer reaktioner baseret på: Ændringerne forekommer (f.eks. Oxidationsreduktion, syre-base, nedbør osv.).
* Eksempel: Neutraliseringsreaktion er en type syre-base-reaktion.
* leverer: En ramme for forståelse og forudsigelse af opførsel af forskellige reaktioner.
7. Spektroskopi:
* bruger elektromagnetisk stråling: Analyserer interaktionen mellem lys og molekyler for at give information om strukturen og dynamikken af reaktanter og produkter.
* Eksempel: Infrarød spektroskopi kan identificere funktionelle grupper, der er til stede i molekyler.
* leverer: Detaljeret information om de kemiske bindinger og molekylstruktur af molekyler involveret i reaktionen.
I sidste ende afhænger den måde, en kemisk reaktion beskrives på, af den specifikke kontekst og det krævede detaljeringsniveau.
 Varme artikler
Varme artikler
-
 Et nyt værktøj til styring af reaktioner i mikrorobotter og mikroreaktorerThomas Russell og Ganhua Xie ved UMass Amherst og Lawrence Berkeley National Lab bruger kapillære kræfter til at udvikle en simpel metode til fremstilling af selvsamlende hængende dråber af en vandig
Et nyt værktøj til styring af reaktioner i mikrorobotter og mikroreaktorerThomas Russell og Ganhua Xie ved UMass Amherst og Lawrence Berkeley National Lab bruger kapillære kræfter til at udvikle en simpel metode til fremstilling af selvsamlende hængende dråber af en vandig -
 Reduktion af den energi, der kræves for at omdanne CO2-affald til værdifulde ressourcerKemisk og biomolekylær ingeniørprofessor og afdelingsformand Paul Kenis, ret, og kandidatstuderende Shawn Lu er medforfattere til en ny undersøgelse, der undersøger gennemførligheden af en ny CO2-sp
Reduktion af den energi, der kræves for at omdanne CO2-affald til værdifulde ressourcerKemisk og biomolekylær ingeniørprofessor og afdelingsformand Paul Kenis, ret, og kandidatstuderende Shawn Lu er medforfattere til en ny undersøgelse, der undersøger gennemførligheden af en ny CO2-sp -
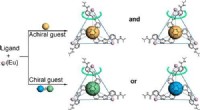 Forskere opnår gæstedrevet selvsamling og chiral induktion af fotofunktionelle lanthanid-tetraedri…Kredit:Chinese Academy of Sciences Chirale koordinationsbure har potentielle anvendelser inden for enantioselektiv genkendelse, sansning og symmetrisk katalyse. Generelt kan chirale koordinationsbu
Forskere opnår gæstedrevet selvsamling og chiral induktion af fotofunktionelle lanthanid-tetraedri…Kredit:Chinese Academy of Sciences Chirale koordinationsbure har potentielle anvendelser inden for enantioselektiv genkendelse, sansning og symmetrisk katalyse. Generelt kan chirale koordinationsbu -
 Spyttest for cannabis kan en dag hjælpe med at identificere handicappede bilisterEn ny enhed kan en dag blive brugt til at opdage marihuanaforgiftning ved vejkanter. Kredit:Shalini Prasad I USA, de, der indtager alkohol og kører bil, bliver ofte udsat for standsninger ved veje
Spyttest for cannabis kan en dag hjælpe med at identificere handicappede bilisterEn ny enhed kan en dag blive brugt til at opdage marihuanaforgiftning ved vejkanter. Kredit:Shalini Prasad I USA, de, der indtager alkohol og kører bil, bliver ofte udsat for standsninger ved veje


