Hvad er fakta kemiske reaktioner?
hvad de er:
* omarrangement af atomer: Kemiske reaktioner involverer brud og dannelse af kemiske bindinger mellem atomer. Dette resulterer i omarrangement af atomer til dannelse af nye stoffer med forskellige egenskaber.
* Energiændringer: Kemiske reaktioner involverer energiændringer. Nogle reaktioner frigiver energi (eksotermiske reaktioner), mens andre kræver energiindgang (endotermiske reaktioner).
* bevarelse af masse: I en kemisk reaktion svarer den samlede masse af reaktanterne (udgangsmaterialer) altid den samlede masse af produkterne (stoffer dannet). Dette er kendt som loven om bevarelse af masse.
Typer af reaktioner:
* Synteseaktioner: To eller flere stoffer kombineres for at danne et nyt stof. Eksempel:2H₂ + O₂ → 2H₂O (dannelse af vand)
* Nedbrydningsreaktioner: Et enkelt stof opdeles i to eller flere enklere stoffer. Eksempel:2H₂O → 2H₂ + O₂ (elektrolyse af vand)
* enkeltfortrængningsreaktioner: Et element erstatter et andet element i en forbindelse. Eksempel:Zn + Cuso₄ → Znso₄ + Cu
* Dobbeltfortrængningsreaktioner: To forbindelser udveksler ioner eller grupper af atomer. Eksempel:Agno₃ + NaCl → AgCl + Nano₃
* forbrændingsreaktioner: Et stof reagerer hurtigt med ilt og producerer varme og lys. Eksempel:Ch₄ + 2o₂ → CO₂ + 2H₂O
* syre-base-reaktioner: En syre reagerer med en base for at danne salt og vand. Eksempel:HCL + NaOH → NaCl + H₂O
Faktorer, der påvirker reaktionshastigheden:
* Temperatur: Højere temperaturer øger generelt reaktionshastigheder, fordi molekyler bevæger sig hurtigere, hvilket øger hyppigheden af kollisioner.
* Koncentration: Højere koncentrationer af reaktanter fører til flere kollisioner, hvilket øger reaktionshastigheden.
* overfladeareal: Forøgelse af overfladearealet for en fast reaktant (f.eks. Ved at slibe det) udsætter flere molekyler for kollisioner og fremskynder reaktionen.
* katalysator: En katalysator fremskynder en reaktion uden at blive fortæret selv. Det giver en alternativ reaktionsvej med en lavere aktiveringsenergi.
Andre vigtige noter:
* reversible reaktioner: Nogle reaktioner kan fortsætte i begge retninger.
* ligevægt: En tilstand, hvor hastighederne for de fremadgående og omvendte reaktioner er ens.
* Aktiveringsenergi: Den minimale energi, der kræves for reaktanter til at starte en kemisk reaktion.
Fortæl mig, hvis du gerne vil vide mere om en bestemt type kemisk reaktion eller ethvert andet aspekt af dette emne!
Sidste artikelHvad er PH -skalaen baseret på?
Næste artikelHvorfor opfører gasser sig mest ideelt?
 Varme artikler
Varme artikler
-
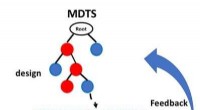 Spillets algoritme, der kan forbedre materialedesignKredit:Videnskab og teknologi af avancerede materialer Design af avancerede materialer er en kompleks proces, med mange potentielle kombinationer til præcist at placere atomer i en struktur. Men n
Spillets algoritme, der kan forbedre materialedesignKredit:Videnskab og teknologi af avancerede materialer Design af avancerede materialer er en kompleks proces, med mange potentielle kombinationer til præcist at placere atomer i en struktur. Men n -
 Kemikere designer hurtigere produktionsproces for essentielle sukkerarterKredit:CC0 Public Domain Celler fra alle levende organismer er dækket af et tæt lag af meget komplekse kulhydrater. Disse kulhydrater, som også er kendt som glykaner, er væsentlige mediatorer af e
Kemikere designer hurtigere produktionsproces for essentielle sukkerarterKredit:CC0 Public Domain Celler fra alle levende organismer er dækket af et tæt lag af meget komplekse kulhydrater. Disse kulhydrater, som også er kendt som glykaner, er væsentlige mediatorer af e -
 Super stålprojekt får et stort gennembrudProfessor Huang Mingxin viser et tyndt stykke stykke superstål, der demonstrerer et ultrahøjt brudmodstandsniveau, styrke og smidighed. Kredit:University of Hong Kong Super Steel -projektet ledet
Super stålprojekt får et stort gennembrudProfessor Huang Mingxin viser et tyndt stykke stykke superstål, der demonstrerer et ultrahøjt brudmodstandsniveau, styrke og smidighed. Kredit:University of Hong Kong Super Steel -projektet ledet -
 Bygger krystaller på en meget varm overfladeEn MOCVD -reaktor, der anvender induktionsopvarmning, kan hæve temperaturen på substratet højt nok til at dyrke krystallinsk aluminiumnitrid. Kredit:2018 KAUST En KAUST kemisk reaktor, der fungere
Bygger krystaller på en meget varm overfladeEn MOCVD -reaktor, der anvender induktionsopvarmning, kan hæve temperaturen på substratet højt nok til at dyrke krystallinsk aluminiumnitrid. Kredit:2018 KAUST En KAUST kemisk reaktor, der fungere
- Ny katalysator med en dobbelt funktion til brint- og plastproduktion
- Hvor mange pund er der i 576 ounces?
- Hvad er funktionerne ved fotosyntese?
- Karakterisering af grafens struktur
- Specialbygget molekyle viser løfte som kræftbekæmpelse
- Hvad er den vigtigste overbevisning, som en kristen videnskabsmand skal have?


