Hvorfor opfører gasser sig mest ideelt?
Ideelle gasforudsætninger:
* Punktpartikler: Ideelle gasmolekyler antages at have ubetydelig volumen sammenlignet med volumen af den beholder, de optager.
* Ingen intermolekylære kræfter: Ideelle gasmolekyler tiltrækker ikke eller afviser hinanden.
* perfekt elastiske kollisioner: Kollisioner mellem molekyler er perfekt elastiske, hvilket betyder, at ingen energi går tabt under kollisioner.
Hvorfor lavt tryk og høj temperatur fremmer ideel opførsel:
* Lavt tryk: Ved lave tryk er molekyler langt fra hinanden, hvilket minimerer virkningerne af intermolekylære kræfter og gør antagelsen om "punktpartiklen" mere gyldig.
* Høj temperatur: Ved høje temperaturer bevæger molekyler sig hurtigere, hvilket øger den kinetiske energi og reducerer virkningen af intermolekylære kræfter. Den højere energi gør også kollisioner mere elastiske.
Kortfattet:
* Lavt tryk: Minimerer molekylernes volumen selv og minimerer intermolekylære attraktioner.
* Høj temperatur: Maksimerer den kinetiske energi, minimerer virkningen af attraktive kræfter og gør kollisioner mere elastiske.
Ægte gasser og afvigelser:
Ægte gasser afviger fra ideel opførsel ved højt tryk og lav temperatur. Dette er fordi:
* Højt tryk: Molekyler er tættere sammen, hvilket øger vigtigheden af deres eget volumen og intermolekylære kræfter.
* Lav temperatur: Molekyler bevæger sig langsommere, øger virkningen af attraktive kræfter og gør kollisioner mindre elastiske.
Konklusion:
Gasser opfører sig mest ideelt under betingelser med lavt tryk og høj temperatur, fordi disse forhold minimerer afvigelserne fra de ideelle gasforudsætninger. Ved højt tryk og lav temperatur afviger reelle gasser fra ideel opførsel på grund af påvirkningen af molekylær volumen og intermolekylære kræfter.
Sidste artikelHvad er fakta kemiske reaktioner?
Næste artikelHvorfor brintgas indsamlet ved opadgående levering?
 Varme artikler
Varme artikler
-
 Verdens ældste periodiske diagram fundet i St. AndrewsPeriodisk bordvaskebehandling. Kredit:University of St. Andrews Et periodisk tabeldiagram opdaget ved University of St Andrews menes at være det ældste i verden. Diagrammet af elementer, stammer
Verdens ældste periodiske diagram fundet i St. AndrewsPeriodisk bordvaskebehandling. Kredit:University of St. Andrews Et periodisk tabeldiagram opdaget ved University of St Andrews menes at være det ældste i verden. Diagrammet af elementer, stammer -
 Teamet skaber kort til produktion af miljøvenlige metallerJaclyn Lunger er førsteforfatter til et papir, der beskriver reaktionerne - på atomniveau - bag en miljøvenlig måde at fremstille metaller på. Kredit:Yang Shao-Horn, MIT I arbejde, der kunne indled
Teamet skaber kort til produktion af miljøvenlige metallerJaclyn Lunger er førsteforfatter til et papir, der beskriver reaktionerne - på atomniveau - bag en miljøvenlig måde at fremstille metaller på. Kredit:Yang Shao-Horn, MIT I arbejde, der kunne indled -
 Leverer tryk med en ukonventionel krystalgrænsefladeKredit:Rensselaer Polytekniske Institut Brugen af tryk til at ændre halvlederegenskaber viser stigende lovende i applikationer som højtydende infrarøde sensorer og energikonverteringsenheder. Me
Leverer tryk med en ukonventionel krystalgrænsefladeKredit:Rensselaer Polytekniske Institut Brugen af tryk til at ændre halvlederegenskaber viser stigende lovende i applikationer som højtydende infrarøde sensorer og energikonverteringsenheder. Me -
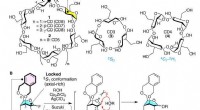 Forskere finder en måde at syntetisere små cyclodextriner påStrukturer af CDer og nøgleelementer muliggjorde syntese af 3 og 4. (A) På grund af de anstrengte glucopyranose-ringe i 3 og 4, deres eksistens blev anset for usandsynlig. (B) Konception af EDB-broen
Forskere finder en måde at syntetisere små cyclodextriner påStrukturer af CDer og nøgleelementer muliggjorde syntese af 3 og 4. (A) På grund af de anstrengte glucopyranose-ringe i 3 og 4, deres eksistens blev anset for usandsynlig. (B) Konception af EDB-broen
- Denne citron kan hjælpe maskinlæring med at skabe bedre lægemidler
- Sådan konverteres SCFM til CFM
- Sådan beregnes forstørrelse på et lysmikroskop
- Hvad er to måder, hvor enzymer bliver mindre effektive?
- Fremtidig vejrudsigt - det hele er i MRI af skyer
- Chilensk Patagonia:et friluftslaboratorium til undersøgelse af klimaændringer


