Hvordan ligner staterne af vand, der ligner staten i de fleste andre stoffer?
* Stater af stof: Alt stof findes i tre primære tilstande:fast, flydende og gas. Vand er ingen undtagelse.
* faseovergange: Overgange mellem disse tilstande (smeltning, frysning, kogning, kondens, sublimering, afsætning) er drevet af ændringer i temperatur og tryk. Disse overgange observeres også i de fleste stoffer.
* Energiændringer: Faseovergange involverer energiændringer. For eksempel kræver smeltning energiindgang (endotermisk), mens frysning frigiver energi (eksoterme). Dette gælder også for de fleste stoffer.
* molekylær arrangement: Arrangementet af molekyler ændres mellem tilstande. I faste stoffer er molekyler tæt pakket og har faste positioner. I væsker er molekyler tættere sammen, men kan bevæge sig mere frit. I gasser er molekyler langt fra hinanden og bevæger sig frit. Dette mønster gælder for mange stoffer.
Der er dog nogle forskelle mellem vand og andre stoffer:
* anomal ekspansion: I modsætning til de fleste stoffer udvides vand, når det fryser, hvorfor is flyder.
* Høj varmekapacitet: Vand har en meget høj varmekapacitet, hvilket betyder, at det kræver en masse energi at ændre dens temperatur. Dette hjælper med at regulere Jordens klima.
* stærk brintbinding: De stærke hydrogenbindinger mellem vandmolekyler er ansvarlige for mange af dens unikke egenskaber, såsom dets høje kogepunkt og overfladespænding.
Samlet set, mens vand deler de grundlæggende egenskaber ved tilstande med andre stoffer, får dens unikke egenskaber på grund af brintbinding, det skiller sig ud.
 Varme artikler
Varme artikler
-
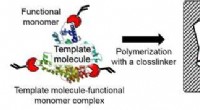 Meget følsom metode til at opdage potentiel cancerbiomarkørFigur 2:Koncept for molekylær prægningsteknologi. Kredit:Kobe University Exosomer regulerer intercellulær kommunikation i kræftformer, og henleder opmærksomheden som en potentiel kræftbiomarkør. E
Meget følsom metode til at opdage potentiel cancerbiomarkørFigur 2:Koncept for molekylær prægningsteknologi. Kredit:Kobe University Exosomer regulerer intercellulær kommunikation i kræftformer, og henleder opmærksomheden som en potentiel kræftbiomarkør. E -
 3-D-print og månestøv:Et astronautsæt til fremtidig rumudforskning?(a) Foreløbige test for 3-D-printning af måneregolit-simulator NU-LHT-2M på en grundplade af kulstofstål og (b) SEM-billede af samme. Kredit:Politecnico di Milano En af de store udfordringer relat
3-D-print og månestøv:Et astronautsæt til fremtidig rumudforskning?(a) Foreløbige test for 3-D-printning af måneregolit-simulator NU-LHT-2M på en grundplade af kulstofstål og (b) SEM-billede af samme. Kredit:Politecnico di Milano En af de store udfordringer relat -
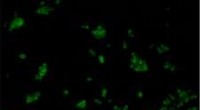 En glødestok, der opdager kræft?Billede genereret af glødesticksonden til kræftceller. Kredit:Prof.Doron Shabat/American Friends of Tel Aviv University (AFTAU) Kemiluminescens, eller kemisk lys, er princippet bag glødestikkerne
En glødestok, der opdager kræft?Billede genereret af glødesticksonden til kræftceller. Kredit:Prof.Doron Shabat/American Friends of Tel Aviv University (AFTAU) Kemiluminescens, eller kemisk lys, er princippet bag glødestikkerne -
 Belysning af nanopartikelvækst med røntgenstrålerBrookhaven Lab-forskere Mingyuan Ge, Iradwikanari Waluyo, og Adrian Hunt er afbildet fra venstre mod højre ved IOS-strålelinjen, hvor de studerede vækstvejen for en effektiv katalysator til brintbrænd
Belysning af nanopartikelvækst med røntgenstrålerBrookhaven Lab-forskere Mingyuan Ge, Iradwikanari Waluyo, og Adrian Hunt er afbildet fra venstre mod højre ved IOS-strålelinjen, hvor de studerede vækstvejen for en effektiv katalysator til brintbrænd
- Forbudte industrielt opløsningsmiddel kaster nyt lys over metan-mysteriet (Opdatering)
- Nye organisk-metaloxid-transistorer med høj driftsstabilitet
- Grib miljømuligheder under et Trump -formandskab
- Til hvilken geologisk tidsramme hører fossilerne fra Thomas Farm?
- Hvor methylalkohol og ethylalkohol?
- Truede skovdyr


