Hvad er de ikke -polære bindinger af SIH4?
Her er hvorfor:
* Elektronegativitetsforskel: Silicium (Si) og brint (H) har lignende elektronegativitetsværdier (SI:1,90, H:2,20). Forskellen i elektronegativitet er meget lille, hvilket betyder, at elektronerne i SI-H-bindingerne deles næsten lige mellem de to atomer.
* symmetri: Den tetrahedrale geometri af SiH4 sikrer, at bindolene (som er meget små på grund af elektronegativitetsforskellen) annullerer hinanden.
Selv om hver SI-H-binding er teknisk let polært, er det samlede molekyle ikke-polært på grund af symmetrien og den minimale polaritet af de individuelle bindinger.
 Varme artikler
Varme artikler
-
 Elektromagnetiske strålingsbeskyttelsesskærme udvikletVismutoverflade med forskellig tæthed under mikroskop. Kredit:A. Trukhanov Miljøet indeholder elektromagnetisk stråling og magnetiske felter af naturlig og kunstig oprindelse. Selv en kort elektro
Elektromagnetiske strålingsbeskyttelsesskærme udvikletVismutoverflade med forskellig tæthed under mikroskop. Kredit:A. Trukhanov Miljøet indeholder elektromagnetisk stråling og magnetiske felter af naturlig og kunstig oprindelse. Selv en kort elektro -
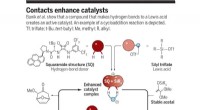 Brug af katalysatorer som en pincet til at vælge en enkelt enantiomer fra et spejlet parBanik et al. viser, at en forbindelse, der laver hydrogenbindinger til en Lewis-syre, danner en aktiv katalysator. Et eksempel på en cycloadditionsreaktion er afbildet. Tf, triflate; t-Bu, tert-butyl;
Brug af katalysatorer som en pincet til at vælge en enkelt enantiomer fra et spejlet parBanik et al. viser, at en forbindelse, der laver hydrogenbindinger til en Lewis-syre, danner en aktiv katalysator. Et eksempel på en cycloadditionsreaktion er afbildet. Tf, triflate; t-Bu, tert-butyl; -
 Kompleks stofskifte kan have samlet sig selv fra simple prækursorerEn reaktion af thioeddikesyre, thioler og jernproducerende thioestere og et jernsulfidmineral. Kredit:Sebastian Sanden, ELSI. Alt moderne liv bruger energi til at reproducere sig selv. Under denne
Kompleks stofskifte kan have samlet sig selv fra simple prækursorerEn reaktion af thioeddikesyre, thioler og jernproducerende thioestere og et jernsulfidmineral. Kredit:Sebastian Sanden, ELSI. Alt moderne liv bruger energi til at reproducere sig selv. Under denne -
 Lys og peptider:Ny metode diversificerer livets naturlige byggestenSollys eksperiment. Reaktionerne kan udføres ved hjælp af lyset fra solen i en enkel glaskolbe. Kredit:J. Waser/EPFL Opdagelse af nye biologiske mål er en kritisk del af vores igangværende kamp mo
Lys og peptider:Ny metode diversificerer livets naturlige byggestenSollys eksperiment. Reaktionerne kan udføres ved hjælp af lyset fra solen i en enkel glaskolbe. Kredit:J. Waser/EPFL Opdagelse af nye biologiske mål er en kritisk del af vores igangværende kamp mo


