Hvad er forholdet på besat af 1 mol O2 og O3?
forståelse af konceptet
* Avogadros lov: Stater, der er lige mængder af ideelle gasser ved den samme temperatur og tryk, indeholder det samme antal molekyler.
* Ideel gaslov: Forholder tryk (p), volumen (v), antal mol (n) og temperatur (t) på en ideel gas:PV =NRT (hvor R er den ideelle gaskonstant).
antagelser
Vi antager, at både O₂ og O₃ er ideelle gasser ved den samme temperatur og tryk.
Beregninger
1. mol er ens: Da vi har 1 mol af hver gas, er antallet af molekyler det samme (Avogadros lov).
2. Ideel gaslov: Da temperaturen og trykket er konstant, er volumen direkte proportional med antallet af mol (fra den ideelle gaslov).
3. Konklusion: Da antallet af molekyler (og derfor mol) er det samme, vil volumenet, der er optaget af 1 mol O₂, være lig med det volumen, der er optaget af 1 mol O₃.
Derfor er forholdet mellem volumenet, der er besat af 1 mol O₂ til det volumen, der er besat af 1 mol O₃ 1:1.
Vigtig note: Dette antager ideel gasadfærd. I virkeligheden afviger gasser lidt fra ideel opførsel, især ved høje tryk eller lave temperaturer.
Sidste artikelHvad er vandopløselige næringsstoffer?
Næste artikelHvad er virkningen af salt på eddike?
 Varme artikler
Varme artikler
-
 Højtydende elektrokatalysatorer til at drive udviklingen af direkte ethanolbrændselscellerKombinerer kerne-skal-konstruktion med en legeringseffekt for at øge palladiums katalytiske ydeevne i ethanoloxidationsreaktioner. Kredit:YANG Jun Forskere fra Institute of Process Engineering (IP
Højtydende elektrokatalysatorer til at drive udviklingen af direkte ethanolbrændselscellerKombinerer kerne-skal-konstruktion med en legeringseffekt for at øge palladiums katalytiske ydeevne i ethanoloxidationsreaktioner. Kredit:YANG Jun Forskere fra Institute of Process Engineering (IP -
 En meget alkalisk stabil Co3O4@Co-MOF-komposit til højtydende elektrokemisk energilagringEt søjlediagram til sammenligning af kapacitansydelse af elektrodematerialer. Kredit:©Science China Press Metal-organiske rammer (MOFer) dannes via selvsamling af metalioner og organiske linkere.
En meget alkalisk stabil Co3O4@Co-MOF-komposit til højtydende elektrokemisk energilagringEt søjlediagram til sammenligning af kapacitansydelse af elektrodematerialer. Kredit:©Science China Press Metal-organiske rammer (MOFer) dannes via selvsamling af metalioner og organiske linkere. -
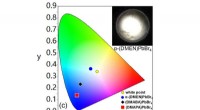 Ændring af den interne struktur af 2-D hybrid perovskit materialer får dem til at udsende hvidt ly…Farvekoordinatkortet illustrerer lysets farver, der udsendes af forskellige hybridperovskitter (med varierende grader af intern strukturel forvrængning) i forhold til ren hvid (svarende til den gule c
Ændring af den interne struktur af 2-D hybrid perovskit materialer får dem til at udsende hvidt ly…Farvekoordinatkortet illustrerer lysets farver, der udsendes af forskellige hybridperovskitter (med varierende grader af intern strukturel forvrængning) i forhold til ren hvid (svarende til den gule c -
 Sprøjtetørring til fremstilling af nye materialer i industrielle applikationerDiagram over de forskellige materialer, der kan fås ved spraytørring. Kredit:ICN2 Spraytørring er en industriel teknik baseret på forstøvning af en opløsning til aerosoldråber, der igen fordampes
Sprøjtetørring til fremstilling af nye materialer i industrielle applikationerDiagram over de forskellige materialer, der kan fås ved spraytørring. Kredit:ICN2 Spraytørring er en industriel teknik baseret på forstøvning af en opløsning til aerosoldråber, der igen fordampes
- Beregningsmetode giver hurtigere højopløsnings massespektrometrisk billeddannelse
- Bekymrende fund i Californiens klimainitiativ afslører problemer med at bruge skove til at kompense…
- Astronomer observerer blazar S5 0836+710 under høj aktivitetsperiode, opdage to gammastråleudbrud
- Solar Water Heater Component Parts
- Soldrevet dyresporing transformerer, hvordan forskere indsamler data om dyr i naturen
- Digital Sky Survey kortlægger hele himlen, at levere nye data til astronomer


