Hvorfor er elektroner så reaktive?
* De har en negativ afgift: Denne ladning skaber en elektrostatisk tiltrækningskraft til positivt ladede partikler (protoner) og en kraft af frastødning til andre negativt ladede partikler. Dette samspil af kræfter driver mange kemiske reaktioner.
* de besætter den yderste skal af et atom: Dette betyder, at de løst holdes og let påvirkes af andre atomer. Jo længere væk fra kernen en elektron er, jo mindre tæt er det bundet.
* de har en relativt lav ioniseringsenergi: Dette betyder, at de kræver, at mindre energi fjernes fra et atom, hvilket gør dem mere tilbøjelige til at deltage i kemiske reaktioner, hvor de er opnået, tabt eller deles.
Sådan bidrager disse faktorer til reaktivitet:
* binding: Elektroner spiller en afgørende rolle i dannelsen af kemiske bindinger mellem atomer. De kan deles (kovalent binding) eller overføres (ionisk binding) for at opnå en mere stabil tilstand.
* Oxidationsreduktionsreaktioner: Elektroner opnås og mistes i redoxreaktioner, som er essentielle for mange biologiske processer og kemiske reaktioner.
* Elektromagnetisme: Den negative ladning af elektroner gør dem meget lydhøre over for elektriske og magnetiske felter. Dette er grundlaget for mange elektroniske enheder og teknologier.
Vigtig note: Ikke alle elektroner er lige så reaktive. Electrons reaktivitet afhænger af faktorer som dets energiniveau, atomnummeret for det element, det hører til og det omgivende miljø.
Her er nogle eksempler på reaktive elektroner i handling:
* natrium (NA): Natrium har et enkelt elektron i sin yderste skal, hvilket gør det meget reaktivt. Det mister let dette elektron til at danne en positiv ion, hvilket gør ioniske bindinger med elementer som klor.
* ilt (O): Oxygen har seks elektroner i sin yderste skal, hvilket efterlader den med to "tomme" pletter. Den danner let kovalente bindinger med andre elementer, inklusive sig selv, for at udfylde disse pletter.
Generelt er reaktiviteten af elektroner et grundlæggende aspekt af kemi og fysik, der driver mange vigtige fænomener i vores verden.
 Varme artikler
Varme artikler
-
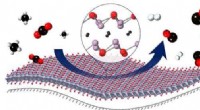 Katalysator for bæredygtig gassynteseEn tynd film af metaloxycarbider på en oxidbærer letter reaktionen mellem CO 2 og methan (CH4) til fremstilling af hydrogen (H2) og kulilte (CO). Kredit:Alexey Kurlov, Evgenia Deeva / ETH Zürich
Katalysator for bæredygtig gassynteseEn tynd film af metaloxycarbider på en oxidbærer letter reaktionen mellem CO 2 og methan (CH4) til fremstilling af hydrogen (H2) og kulilte (CO). Kredit:Alexey Kurlov, Evgenia Deeva / ETH Zürich -
 Video:Kemien ved madlavningKredit:The American Chemical Society Voldsomme køkkengadgets som langsomme komfurer og trykkogere fylder meget. Mange mennesker spekulerer måske på, om det er umagen værd at eje så mange glorifice
Video:Kemien ved madlavningKredit:The American Chemical Society Voldsomme køkkengadgets som langsomme komfurer og trykkogere fylder meget. Mange mennesker spekulerer måske på, om det er umagen værd at eje så mange glorifice -
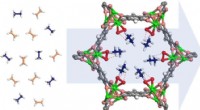 Nyt materiale kunne gøre plastikfremstilling mere energieffektivDenne jernbaserede metal-organiske ramme dekoreret med peroxo-grupper (røde og grønne) kan fange ethan (blå molekyler), mens den tillader ethylen (ferskenmolekyler) at passere igennem, potentielt give
Nyt materiale kunne gøre plastikfremstilling mere energieffektivDenne jernbaserede metal-organiske ramme dekoreret med peroxo-grupper (røde og grønne) kan fange ethan (blå molekyler), mens den tillader ethylen (ferskenmolekyler) at passere igennem, potentielt give -
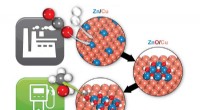 Chemists ID katalytisk nøgle til omdannelse af CO2 til methanolBrookhaven-forskere har identificeret, hvordan en zink/kobber (Zn/Cu) katalysator omdanner kuldioxid (to røde og en grå kugler) og brint (to hvide kugler) til methanol (en grå, en rød, og fire hvide k
Chemists ID katalytisk nøgle til omdannelse af CO2 til methanolBrookhaven-forskere har identificeret, hvordan en zink/kobber (Zn/Cu) katalysator omdanner kuldioxid (to røde og en grå kugler) og brint (to hvide kugler) til methanol (en grå, en rød, og fire hvide k
- Hvad er vigtigheden af mål i livet?
- Mobile biografer i Kina er en linse på samfundet
- Astronomer undersøger emissionen fra en nærliggende pulsarvindtåge
- Et generelt sæt principper understøttet af beviser, der forklarer en vis aspekt?
- Hvordan begynder stjerner at smelte sammen?
- Ferskvands kysterosion ændrer det globale kulstofbudget


