Hvor mange samlede valenselektroner har NaCl?
* ionisk binding: I NaCl mister natrium (NA) sin ene valenselektron for at blive en positivt ladet ion (Na+), mens klor (CL) får, at elektronet bliver en negativt ladet ion (Cl-).
* Ingen delte elektroner: Elektronerne deles ikke mellem atomerne som i en kovalent binding. I stedet holder den elektrostatiske tiltrækning mellem de modsatte ladede ioner forbindelsen sammen.
Derfor er det ikke passende at tale om det samlede antal valenselektroner i NaCl.
 Varme artikler
Varme artikler
-
 Ny undersøgelse afslører, at protonhydreringsstrukturer er asymmetriskeKredit:CC0 Public Domain Hvordan vand solvaterer og transporterer protoner er et grundlæggende spørgsmål, som både kemikere og biologer står over for, og det er afgørende for vores forståelse af p
Ny undersøgelse afslører, at protonhydreringsstrukturer er asymmetriskeKredit:CC0 Public Domain Hvordan vand solvaterer og transporterer protoner er et grundlæggende spørgsmål, som både kemikere og biologer står over for, og det er afgørende for vores forståelse af p -
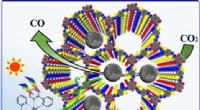 Ny undersøgelse belyser design af heterogene katalysatorer til selektiv kuldioxidfotoreduktionKredit:WANG Ruihus gruppe Anvendelse af kovalente organiske rammer (COFer) som heterogene katalysatorer for fotokatalytisk CO 2 reduktion har tiltrukket sig betydelig opmærksomhed på grund af de
Ny undersøgelse belyser design af heterogene katalysatorer til selektiv kuldioxidfotoreduktionKredit:WANG Ruihus gruppe Anvendelse af kovalente organiske rammer (COFer) som heterogene katalysatorer for fotokatalytisk CO 2 reduktion har tiltrukket sig betydelig opmærksomhed på grund af de -
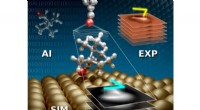 Ny tværfaglig tilgang til at identificere komplekse molekylære adsorbaterKunstig intelligens (AI) forbedret ab-initio struktursøgning kombineres med atomic force microscopy simulations (SIM) og eksperimenter (EXP) for at detektere konfigurationer af omfangsrige 3D-adsorbat
Ny tværfaglig tilgang til at identificere komplekse molekylære adsorbaterKunstig intelligens (AI) forbedret ab-initio struktursøgning kombineres med atomic force microscopy simulations (SIM) og eksperimenter (EXP) for at detektere konfigurationer af omfangsrige 3D-adsorbat -
 Bakteriefabrikker bruges til at opdage potentielle nye malariamedicinDerivater af violacein. Kredit:Hung-En Lai Forskere har konstrueret bakterier til at producere nye versioner af et potentielt antibiotisk molekyle, nogle med kraftige antimalariaegenskaber. Brug
Bakteriefabrikker bruges til at opdage potentielle nye malariamedicinDerivater af violacein. Kredit:Hung-En Lai Forskere har konstrueret bakterier til at producere nye versioner af et potentielt antibiotisk molekyle, nogle med kraftige antimalariaegenskaber. Brug
- Nyt RNA-modificerende værktøj korrigerer genetiske sygdomme, herunder driver af triple-negativ bry…
- Fremtidige kort:Vi har blueprint for beboelig, lavemissionsbyer
- Hvilken jordform er udskåret fra rindende vand?
- Styring af stofs egenskaber i todimensionelle krystaller
- Hvad er eksemplerne på kondensering?
- Glem hajer... her er grunden til, at du er mere tilbøjelig til at blive såret af affald på strand…


