Hvad sker der normalt med elektronkonfigurationen af et atom, når det dannes?
1. At vinde eller miste elektroner:
* At vinde elektroner: Atomer med en høj elektronegativitet (som ikke -metaller) har en tendens til at få elektroner for at opnå en stabil oktetkonfiguration i deres yderste skal. Dette resulterer i dannelsen af en negativt ladet ion (anion).
* taber elektroner: Atomer med en lav elektronegativitet (som metaller) har en tendens til at miste elektroner for at opnå en stabil konfiguration ved at fjerne elektroner fra deres yderste skal. Dette resulterer i dannelsen af en positivt ladet ion (kation).
2. Deling af elektroner:
* kovalent binding: Atomer deler elektroner for at opnå en stabil oktetkonfiguration. Denne deling resulterer i dannelsen af en kovalent binding, hvor begge atomer har et delt elektronpar i deres yderste skal.
Eksempel:
* natrium (NA) Har en elektron i sin yderste skal. Når det danner en ionisk binding med chlor (CL), mister det dette elektron til at blive en Na+ -ion med en stabil elektronkonfiguration som NEON (NE).
* klor (Cl) Har syv elektroner i sin yderste skal. Det får en elektron fra natrium for at blive en klodser og opnå en stabil elektronkonfiguration som Argon (AR).
Vigtige punkter:
* Ændringen i elektronkonfiguration er drevet af ønsket om at opnå en stabil octet -konfiguration i den yderste skal efter oktetreglen.
* Den dannede bindingstype afhænger af elektronegativitetsforskellen mellem atomerne.
* Elektronkonfigurationen ændres kun i den yderste skal, mens de indre skaller forbliver upåvirket.
Fortæl mig, hvis du gerne vil vide mere om specifikke eksempler eller have yderligere spørgsmål.
Sidste artikelEr et atom med atomnummer på 1 stall?
Næste artikelHvilket materiale brænder koldt?
 Varme artikler
Varme artikler
-
 Ioniske solceller kunne levere on-demand vandafsaltningKunstnerens gengivelse af bipolar-membran design til ionisk elektricitetsproduktion. Kredit:William White Moderne solceller, som bruger energi fra lys til at generere elektroner og huller, der der
Ioniske solceller kunne levere on-demand vandafsaltningKunstnerens gengivelse af bipolar-membran design til ionisk elektricitetsproduktion. Kredit:William White Moderne solceller, som bruger energi fra lys til at generere elektroner og huller, der der -
 Innovationens søde smagKredit:CC0 Public Domain Ville den iskolde flaske sodavand smage så forfriskende, vel vidende at den indeholder 65 gram (5 spsk) tilsat sukker? Med en ny amerikansk fødevaremærkningspolitik sat i
Innovationens søde smagKredit:CC0 Public Domain Ville den iskolde flaske sodavand smage så forfriskende, vel vidende at den indeholder 65 gram (5 spsk) tilsat sukker? Med en ny amerikansk fødevaremærkningspolitik sat i -
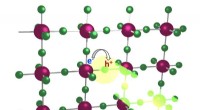 Organiske afstandsstykker forbedrer LED-ydeevnenEn illustration, der viser arbejdsprincippet for en lysemitterende diode lavet af halvledende materialer arrangeret i en perovskit krystalstruktur. Lyspartikler, eller fotoner, udsendes, når elektrone
Organiske afstandsstykker forbedrer LED-ydeevnenEn illustration, der viser arbejdsprincippet for en lysemitterende diode lavet af halvledende materialer arrangeret i en perovskit krystalstruktur. Lyspartikler, eller fotoner, udsendes, når elektrone -
 3-D printede væv og organer uden stilladsetKredit:CC0 Public Domain Konstrueret væv og organer er blevet dyrket med forskellige grader af succes i laboratorier i mange år. Mange af dem har brugt en stilladsfremgangsmåde, hvor celler sås på
3-D printede væv og organer uden stilladsetKredit:CC0 Public Domain Konstrueret væv og organer er blevet dyrket med forskellige grader af succes i laboratorier i mange år. Mange af dem har brugt en stilladsfremgangsmåde, hvor celler sås på
- En effektiv metode til at adskille O-18 fra O-16, afgørende for brug i kræftbehandling
- Grøn drøm:Kan FN-topmøde genoplive klimaspørgsmålet?
- Kilden til termisk energi i en forbrændingsmotor?
- Hvad er tre vigtigste klimazoner, hvor aztekerne eksisterede?
- Stenværktøj fortæller historien om neandertalerjagt
- Nye syrefaste membraner til spildevandsrensning udviklet


