Er partikler i en væske tiltrukket af hinanden?
Her er hvorfor:
* Intermolekylære kræfter: Tiltrækningen mellem partikler i en væske skyldes intermolekylære kræfter. Disse kræfter er svagere end de ioniske eller kovalente bindinger inden for molekyler, men er stadig betydelige. Almindelige intermolekylære kræfter inkluderer hydrogenbinding, dipol-dipol-interaktioner og London-spredningskræfter.
* Stater af stof:
* faste stoffer: Partikler er tæt pakket og holdes sammen af stærke intermolekylære kræfter, hvilket resulterer i en fast form og volumen.
* væsker: Partikler er tættere sammen end i en gas, men har mere frihed til at bevæge sig rundt. De intermolekylære kræfter er stærke nok til at holde partiklerne i nærheden, men ikke så stærke, at de er låst i en fast position.
* Gasser: Partikler er langt fra hinanden og har meget svage intermolekylære kræfter. De bevæger sig frit og fylder den tilgængelige plads.
Styrken af de intermolekylære kræfter bestemmer væskeens egenskaber, såsom dens viskositet (modstand mod flow) og kogepunkt. Væsker med stærkere intermolekylære kræfter har en tendens til at være mere tyktflydende og har højere kogepunkter.
Sidste artikelHvad er den ædle gasnotation for HF?
Næste artikelHvad er tilskuerionerne i 2 timer SO42- CA2 2i-caso4?
 Varme artikler
Varme artikler
-
 Lerbaseret antimikrobiel emballage holder maden friskKontroltomater (til venstre) rådnede efter seks dage, mens de, der var pakket ind i en ny lerbaseret film (til højre) forblev friske. Kredit:Hayriye Ünal Nogle gange ser det ud som om frisk frugt,
Lerbaseret antimikrobiel emballage holder maden friskKontroltomater (til venstre) rådnede efter seks dage, mens de, der var pakket ind i en ny lerbaseret film (til højre) forblev friske. Kredit:Hayriye Ünal Nogle gange ser det ud som om frisk frugt, -
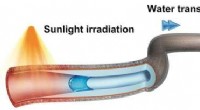 Hurtig kontrolleret transport af vanddråber via sollyspumpeKredit:Wiley Drevet af naturligt eller kunstigt sollys, en ny mikrorørspumpe transporterer vanddråber over lange afstande. Som rapporteret af kinesiske forskere i Journal Angewandte Chemie , pum
Hurtig kontrolleret transport af vanddråber via sollyspumpeKredit:Wiley Drevet af naturligt eller kunstigt sollys, en ny mikrorørspumpe transporterer vanddråber over lange afstande. Som rapporteret af kinesiske forskere i Journal Angewandte Chemie , pum -
 Egenskaber af katalysatorer studeret med gammastråleresonansKredit:Kazan Federal University Dampstøttede olieudvindingsmetoder til tunge aflejringer har længe været i fokus på Kazan Federal University. I særdeleshed, Der lægges stor vægt på in-situ forbræn
Egenskaber af katalysatorer studeret med gammastråleresonansKredit:Kazan Federal University Dampstøttede olieudvindingsmetoder til tunge aflejringer har længe været i fokus på Kazan Federal University. I særdeleshed, Der lægges stor vægt på in-situ forbræn -
 Forbindelse gør det muligt at styre bakteriel kommunikation af lysBestråling opsætning til at skifte den fotoswitchable modulator af bakteriel kommunikation fra trans-isomeren til den mere aktive cis-isomer. Kredit:Dusan Kolarski, University of Groningen Forsker
Forbindelse gør det muligt at styre bakteriel kommunikation af lysBestråling opsætning til at skifte den fotoswitchable modulator af bakteriel kommunikation fra trans-isomeren til den mere aktive cis-isomer. Kredit:Dusan Kolarski, University of Groningen Forsker
- Sådan fungerer båndoptagere
- Hvornår skal man have et barn? En ny tilgang til beslutningen
- Er Valles Marineris ens i størrelse som Grand Canyon?
- United Technologies bryder ind i 3 uafhængige virksomheder
- Hvordan menneskelige aktiviteter påvirker en af verdens mest fjerntliggende hvalarter
- Tokyo-området lukker ned, da kraftig tyfon slår Japan (Opdatering)


