Hvad er en varmereaktion?
1. Kemisk reaktion med varmeoverførsel:
* Dette er den mest almindelige fortolkning. A kemisk reaktion er en proces, hvor atomer og molekyler omarrangerer for at danne nye stoffer. Nogle reaktioner frigiver varmeenergi ( eksotermiske reaktioner ) og andre absorberer varmeenergi ( endotermiske reaktioner ).
* Eksempler:
* Brændende træ (eksoterm) - frigiver varme og lys.
* Opløsning af ammoniumnitrat i vand (endotermisk) - absorberer varme, hvilket gør vandet koldere.
2. Reaktionsvarme:
* Dette henviser til Ændring i entalpi (varmeindhold) af en kemisk reaktion.
* positiv reaktionsvarme Angiver en endotermisk reaktion og negativ reaktionsvarme angiver en eksoterm reaktion.
* Det måles i joules (j) eller Kilojoules (KJ) pr. mol reaktant.
3. Varmeoverførsel i et system:
* Dette kan henvise til bevægelsen af varmeenergi i et fysisk system, som en beholder med vand opvarmes.
* Det styres af lovene om termodynamik, herunder varmeanvikling, konvektion og stråling.
For at forstå, hvad du mente med "varmereaktion" bedre, skal du give mere kontekst.
For eksempel taler du om:
* En specifik kemisk reaktion og dens varmefrigivelse/absorption?
* Den samlede energibalance i et system?
* En bestemt type varmeoverførsel?
At kende konteksten vil hjælpe med at give et mere nøjagtigt og relevant svar.
 Varme artikler
Varme artikler
-
 Lab afslører hjerte-på-en-chipGennem hjerte-på-en-chip-teknologi - modellering af et menneskeligt hjerte på en konstrueret chip og måling af virkningerne af forbindelseseksponering ved hjælp af mikroelektroder - håber Lawrence Liv
Lab afslører hjerte-på-en-chipGennem hjerte-på-en-chip-teknologi - modellering af et menneskeligt hjerte på en konstrueret chip og måling af virkningerne af forbindelseseksponering ved hjælp af mikroelektroder - håber Lawrence Liv -
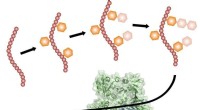 Hvordan patogene bakterier forbereder et klæbrigt adhæsionsproteinPatogene gram-positive bakterier, såsom S. gordonii , eksportere et serinrigt adhæsin for at lette deres binding til værtsceller. Adhesin bruger en dedikeret sekretionsvej, med flere trin, der forek
Hvordan patogene bakterier forbereder et klæbrigt adhæsionsproteinPatogene gram-positive bakterier, såsom S. gordonii , eksportere et serinrigt adhæsin for at lette deres binding til værtsceller. Adhesin bruger en dedikeret sekretionsvej, med flere trin, der forek -
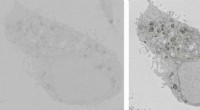 Smart trick muliggør 20 gange hurtigere billeddannelse med elektronmikroskopiTo billeder af en HeLa-celle, begge optaget på 33,6 sekunder. Billedet til højre blev taget, mens en spænding blev påført prøveholderen. Kredit:TU Delft Forskere ved Delft University of Technology
Smart trick muliggør 20 gange hurtigere billeddannelse med elektronmikroskopiTo billeder af en HeLa-celle, begge optaget på 33,6 sekunder. Billedet til højre blev taget, mens en spænding blev påført prøveholderen. Kredit:TU Delft Forskere ved Delft University of Technology -
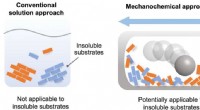 Mod at overvinde opløselighedsproblemer i organisk kemiUopløselige reaktanter er næppe reaktive i opløsning, men kan reagere i opløsningsmiddelfrie systemer ved hjælp af kugleformaling til at drive kemiske reaktioner i fast tilstand. Kredit:Tamae Seo, et
Mod at overvinde opløselighedsproblemer i organisk kemiUopløselige reaktanter er næppe reaktive i opløsning, men kan reagere i opløsningsmiddelfrie systemer ved hjælp af kugleformaling til at drive kemiske reaktioner i fast tilstand. Kredit:Tamae Seo, et
- Atmosfærisk salpetersyrekemi afslører betydeligt undervurderet oxidationskapacitet i det nordlige …
- Dit personlige rum er ikke længere fysisk - det er et globalt datanetværk
- Nuklear engineering forskere udvikler ny elastisk oxiddispersion styrket legering
- Tændernes hemmelige liv:Evo-devo-modeller for tandudvikling
- Sådan konverteres kubiske fødder til Gallons
- Hvad er et eksempel på feltarbejde?


