Hvad er brugen af varme som en praktisk måling af kemisk energi i nogen reaktion?
Kemisk energi opbevares inden for bindingerne af molekyler. Når bindinger er brudt, frigøres energi (eksoterm reaktion), og når der dannes bindinger, absorberes energi (endoterm reaktion). Denne energiændring er det, vi kalder entalpiændring (ΔH) .
varme er en form for energioverførsel, der opstår, når der er en temperaturforskel mellem to systemer. I kemiske reaktioner kan varme frigøres eller absorberes som en konsekvens af entalpiændringen .
Hvorfor varme er ikke et praktisk mål for kemisk energi:
* varme er en vej, ikke en egenskab: Varme beskriver * strømmen * af energi på grund af temperaturforskelle. Kemisk energi er på den anden side en * egenskab * i selve det kemiske system.
* varme afhænger af eksterne faktorer: Mængden af varme, der er frigivet eller absorberet i en reaktion, kan variere afhængigt af faktorer som:
* Mængden af reaktanter: Flere reaktanter betyder mere energi frigivet/absorberet.
* tryk og volumen: Ændringer i disse tilstande kan påvirke entalpiændringen.
* det omgivende miljø: Omgivelsens temperatur og tryk påvirker varmestrømmen.
* varme fortæller ikke hele historien: Varme fortæller os kun om energistrømmen på grund af temperaturforskelle. Det tegner sig ikke for andre former for energiændring, der kan forekomme i en reaktion, såsom:
* arbejde: Nogle reaktioner kan arbejde på omgivelserne (f.eks. Udvidelse af en gas).
* intern energi: Dette inkluderer den energi, der er gemt i molekylernes bevægelse og placering.
Hvad er et praktisk mål for kemisk energi?
* entalpiændring (ΔH): Dette er det mest almindelige og nøjagtige mål for den kemiske energiændring i en reaktion. Det er uafhængigt af eksterne faktorer og konti for alle former for energiændring.
Kortfattet:
* Varme er en konsekvens af ændringer i kemiske energi, ikke et direkte mål for det.
* Entalpiændring (ΔH) er en mere praktisk og nøjagtig måling af kemisk energi i reaktioner.
Sidste artikelHvad er en varmereaktion?
Næste artikelHvad er entalpien for en reaktion?
 Varme artikler
Varme artikler
-
 En ny metode til at genbruge plast sammenForskere har med succes blandet forskellige typer plastik, der skal genbruges sammen, at give en løsning på miljøproblemet med plastaffald og tilføje økonomisk værdi til plastmaterialer. Kredit:Limin
En ny metode til at genbruge plast sammenForskere har med succes blandet forskellige typer plastik, der skal genbruges sammen, at give en løsning på miljøproblemet med plastaffald og tilføje økonomisk værdi til plastmaterialer. Kredit:Limin -
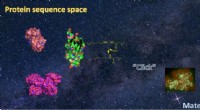 Foto-responsive proteinhydrogeler som middel til kontrolleret frigivelse af stamceller/proteinerMaterialedesign styrket af proteinsekvensrum. Kredit:Institut for Kemisk og Biologisk Teknik, HKUST Hydrogels, kendt for deres biomimetiske egenskaber, er de førende materialer til biomedicinske a
Foto-responsive proteinhydrogeler som middel til kontrolleret frigivelse af stamceller/proteinerMaterialedesign styrket af proteinsekvensrum. Kredit:Institut for Kemisk og Biologisk Teknik, HKUST Hydrogels, kendt for deres biomimetiske egenskaber, er de førende materialer til biomedicinske a -
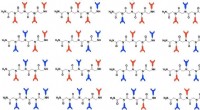 Disse kunstige proteiner har et fast greb om metalIllustration af peptoid kombinationer. Hver af de metalbindende monomerer er repræsenteret som en rød eller blå klo. Kredit:Rebecca Abergel/Berkeley Lab Et team af videnskabsmænd ledet af Berkeley
Disse kunstige proteiner har et fast greb om metalIllustration af peptoid kombinationer. Hver af de metalbindende monomerer er repræsenteret som en rød eller blå klo. Kredit:Rebecca Abergel/Berkeley Lab Et team af videnskabsmænd ledet af Berkeley -
 Undersøgelse afslører en unik måde for cellemigration på bløde viskoelastiske overfladerKredit:CC0 Public Domain Inde i din krop, cellebevægelse spiller en afgørende rolle i mange væsentlige biologiske processer, herunder sårheling, immunreaktioner og den potentielle spredning af kræ
Undersøgelse afslører en unik måde for cellemigration på bløde viskoelastiske overfladerKredit:CC0 Public Domain Inde i din krop, cellebevægelse spiller en afgørende rolle i mange væsentlige biologiske processer, herunder sårheling, immunreaktioner og den potentielle spredning af kræ
- Vietnam fastholder forbud mod dybvandsfiskeri i forurenede områder
- Sådan beregnes acreage fra Perimeter
- New Zealandske embedsmand kalder Facebook for moralsk bankerot
- Hvorfor støj kan øge følsomheden over for svage signaler
- Tilbyder noget universitet i Pakistan studier af astronomi?
- Hvordan løsning af vand-energikonflikter i Centralasien også kan øge produktionen af vedvarende…


