Hvad er entalpien for en reaktion?
Her er en sammenbrud:
* eksotermisk reaktion: ΔH er negativ , hvilket betyder, at varme er frigivet ind i omgivelserne. Reaktionen føles hot . Eksempler inkluderer forbrændings- og neutraliseringsreaktioner.
* endotermisk reaktion: ΔH er positiv , hvilket betyder, at varme er absorberet fra omgivelserne. Reaktionen føles kold . Eksempler inkluderer smeltende is og fotosyntese.
Nøglepunkter:
* Enthalpy Change (ΔH) er en tilstandsfunktion , hvilket betyder, at det kun afhænger af de oprindelige og endelige tilstande i systemet, ikke den sti, der er taget.
* Enthalpien af en reaktion måles normalt i Kilojoules pr. Mol (KJ/mol) .
* Det er vigtigt at bemærke, at entalpiændring er et teoretisk koncept og måler ikke direkte den varme, der udveksles i en reel reaktion. Faktorer som varmetab til miljøet kan påvirke den faktiske varmeændring.
Ansøgninger:
* forudsigelse af muligheden for en reaktion: En negativ ΔH antyder, at en reaktion sandsynligvis vil forekomme spontant.
* Design og optimering af kemiske processer: Forståelse af entalpi -ændringer muliggør design af reaktioner med ønskede varmeeffekter.
* Beregning af energibehov til kemiske processer: Kendskab til entalpiændringer hjælper med at bestemme den energi, der er nødvendig for specifikke reaktioner.
Kortfattet: Enthalpien af en reaktion er en vigtig termodynamisk egenskab, der kvantificerer den varme, der er absorberet eller frigivet under en kemisk transformation, hvilket giver værdifuld indsigt i de involverede energiændringer.
 Varme artikler
Varme artikler
-
 Forskere identificerer bioaktive forbindelser i kakaobælge for at udvikle lægemidler til bekæmpel…María de la Luz Cádiz Gurrea. Kredit:Universitetet i Granada Et internationalt team af forskere, ledet af University of Granada (UGR) i Spanien, har med succes isoleret en bioaktiv forbindelse til
Forskere identificerer bioaktive forbindelser i kakaobælge for at udvikle lægemidler til bekæmpel…María de la Luz Cádiz Gurrea. Kredit:Universitetet i Granada Et internationalt team af forskere, ledet af University of Granada (UGR) i Spanien, har med succes isoleret en bioaktiv forbindelse til -
 Forskere strømliner molekylært samlebånd til design, test lægemiddelforbindelserKredit:Lenny Kuhne/Unsplash Forskere fra North Carolina State University har fundet en måde at finjustere det molekylære samlebånd, der skaber antibiotika via manipuleret biosyntese. Arbejdet kunn
Forskere strømliner molekylært samlebånd til design, test lægemiddelforbindelserKredit:Lenny Kuhne/Unsplash Forskere fra North Carolina State University har fundet en måde at finjustere det molekylære samlebånd, der skaber antibiotika via manipuleret biosyntese. Arbejdet kunn -
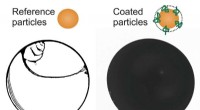 Modificering af overflader med polymerkæder fremmer ensartet tørring af partikelholdige væskerEn væske, der indeholder partikler, viser det karakteristiske tørremønster for en kaffering (til venstre). Hvis overfladen af partiklerne modificeres med overfladeaktive polymerer, tørrer dispersion
Modificering af overflader med polymerkæder fremmer ensartet tørring af partikelholdige væskerEn væske, der indeholder partikler, viser det karakteristiske tørremønster for en kaffering (til venstre). Hvis overfladen af partiklerne modificeres med overfladeaktive polymerer, tørrer dispersion -
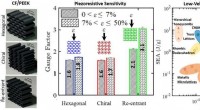 Letvægts, slagfaste bikagestrukturer kan fornemme, når de er blevet beskadigetGrafisk abstrakt. Kredit: Materialer og design (2021). DOI:10.1016/j.matdes.2021.109863 En ny form for letvægts, slagfaste plastbaserede honningkage-strukturer, der kan mærke, hvornår de er bleve
Letvægts, slagfaste bikagestrukturer kan fornemme, når de er blevet beskadigetGrafisk abstrakt. Kredit: Materialer og design (2021). DOI:10.1016/j.matdes.2021.109863 En ny form for letvægts, slagfaste plastbaserede honningkage-strukturer, der kan mærke, hvornår de er bleve
- Corps of Engineers overvejer naturbaseret oversvømmelseskontrol
- Fossiliseret 429 mio. år gammelt øje afspejler moderne insektsyn
- Hold sennep:Hvad gør edderkopper kræsne spisere
- Ekstremt vejr kræver ekstrem handling
- Autoklavpipette Tips
- Greening the greyfields:Sådan fornyer du vores forstæder til mere beboelige, netto-nul-byer


