Hvordan ville interaktionen mellem atomer og deres elektroner afvige i en kovalent binding?
kovalent binding
* Deling af elektroner: I en kovalent binding deler atomer elektroner. Denne deling er det definerende træk ved en kovalent binding.
* ikke-metal-ikke-almetal interaktion: Kovalente bindinger dannes typisk mellem ikke -metaller, som har en stærk affinitet for elektroner.
* stærk binding: Kovalente bindinger er generelt stærke og kræver betydelig energi for at bryde.
* Dannelse af molekyler: Kovalente bindinger fører til dannelse af diskrete molekyler.
* lige eller ulig deling:
* ikke -polær kovalent: Elektronerne deles lige mellem atomerne, hvilket resulterer i en afbalanceret fordeling af ladning.
* polær kovalent: Elektronerne deles ulige, hvilket fører til, at det ene atom har en lidt negativ ladning og den anden med en lidt positiv ladning.
Andre typer binding (til sammenligning)
* ionisk binding: Et atom (typisk et metal) overfører en eller flere elektroner til et andet atom (typisk et ikke -metal). Dette resulterer i dannelsen af ioner med modsatte afgifter, der tiltrækker hinanden.
* Metallisk binding: Elektroner delokaliseres i hele et gitter af metalatomer. Dette skaber et "hav" af elektroner, der kan bevæge sig frit, hvilket fører til de karakteristiske egenskaber ved metaller som ledningsevne og formbarhed.
Nøgleforskelle:
* Elektronoverførsel vs. deling: Den vigtigste forskel mellem kovalente og andre typer bindinger ligger i, hvordan elektroner håndteres. I kovalente bindinger deles elektroner. I ioniske og metalliske bindinger overføres eller delokaliseres elektroner enten.
* obligationsstyrke: Kovalente bindinger er typisk stærkere end ioniske bindinger, men svagere end metalliske bindinger.
* Typer af atomer: Kovalente bindinger dannes mellem ikke -metaller, mens ioniske bindinger dannes mellem metaller og ikke -metaller. Metalliske bindinger dannes mellem metalatomer.
Eksempel:
* kovalent: Vand (H₂O) - Brint- og iltatomerne deler elektroner og danner en polær kovalent binding.
* ionisk: Natriumchlorid (NaCl) - Natriumoverførsler et elektron til klor, danner Na+ og Cl -ioner, der tiltrækker hinanden.
* Metallic: Kobber (Cu) - Kobberatomerne deler en pulje af elektroner, hvilket fører til dets høje ledningsevne og formbarhed.
Fortæl mig, hvis du gerne vil have en mere dybdegående forklaring af et bestemt aspekt!
 Varme artikler
Varme artikler
-
 Video:Sådan interagerer du akavet med mennesker på en bar ved hjælp af kemiKredit:The American Chemical Society Med pandemiske restriktioner ophævet i USA, vi begynder at komme tilbage i verden, mødes med venner og kolleger på restauranter og barer. Hvis du er bekymret,
Video:Sådan interagerer du akavet med mennesker på en bar ved hjælp af kemiKredit:The American Chemical Society Med pandemiske restriktioner ophævet i USA, vi begynder at komme tilbage i verden, mødes med venner og kolleger på restauranter og barer. Hvis du er bekymret, -
 Fra identifikation til et kemisk fingeraftryk for sprængstoffer i retsmedicinsk forskningCobra fyrværkeri. Kredit:Karlijn Bezemer Politiet støder ofte på sprængstoffer i deres retsmedicinske efterforskninger relateret til kriminelle og terroraktiviteter. Kemisk analyse af sprængstoffe
Fra identifikation til et kemisk fingeraftryk for sprængstoffer i retsmedicinsk forskningCobra fyrværkeri. Kredit:Karlijn Bezemer Politiet støder ofte på sprængstoffer i deres retsmedicinske efterforskninger relateret til kriminelle og terroraktiviteter. Kemisk analyse af sprængstoffe -
 Tubulinhæmmer med en unik molekylær virkningsmekanismeFragmentvalg. A) Placering af stedet sID βαII (volumenrepræsentation) ved βTub1-αTub2 interdimer-grænsefladen af T2 R-TTL kompleks. For nemheds skyld er RB3- og TTL-kæderne ikke vist. De to α- og to
Tubulinhæmmer med en unik molekylær virkningsmekanismeFragmentvalg. A) Placering af stedet sID βαII (volumenrepræsentation) ved βTub1-αTub2 interdimer-grænsefladen af T2 R-TTL kompleks. For nemheds skyld er RB3- og TTL-kæderne ikke vist. De to α- og to -
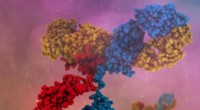 Udvidelse af rækkevidden af terapeutiske antistofferEt enkelt bispecifikt antistof kan binde til flere antigener, resulterer i mere specifik målretning, nye virkningsmekanismer og højere klinisk effektivitet. Kredit:Camilla De Nardis, Linda J.A. Hendri
Udvidelse af rækkevidden af terapeutiske antistofferEt enkelt bispecifikt antistof kan binde til flere antigener, resulterer i mere specifik målretning, nye virkningsmekanismer og højere klinisk effektivitet. Kredit:Camilla De Nardis, Linda J.A. Hendri
- Sådan beregner eksperter OL's CO2-fodaftryk:83 flasker vin pr. person
- Hvad er mere effektivitet el-kedel og kogeplade?
- Hvad er et rent stof klassificeret som?
- Første højopløsnings 3D nanoskala kemisk billeddannelse opnået med multimodal tomografi
- Flere patruljer, færre sejlere til SpaceX splashdown lørdag
- Undersøgelse identificerer tekniske udfordringer for kvinder, der overgår fra fængsling


