Tubulinhæmmer med en unik molekylær virkningsmekanisme
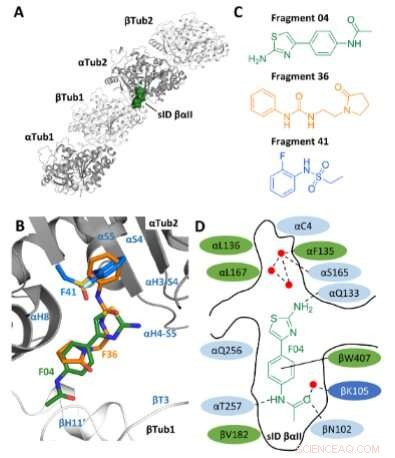
Fragmentvalg. A) Placering af stedet sID βαII (volumenrepræsentation) ved βTub1-αTub2 interdimer-grænsefladen af T2 R-TTL kompleks. For nemheds skyld er RB3- og TTL-kæderne ikke vist. De to α- og to β-tubulin monomerer i T2 R-TTL-kompleks er vist i henholdsvis gråt og hvidt bånd. B) Overlejring af F04-, F36- og F41-bindingspositionerne (PDB ID'er 5S4O, 5S5K og 5S5P, henholdsvis). Sekundære strukturelementer af tubulin er mærket med blåt. Kulstofatomer er farvet med grønt for F04, orange for fragment F36 og lyseblåt for fragment F41. Nitrogenatomer er farvet i blåt, oxygenatomer i rødt, svovlatomer i gult, og fluoratomer i lysegrønt. C) Kemiske strukturer af fragmenter F04, F36 og F41. D) Skematisk repræsentation af F04 bundet til site sID βαII. Rester, der danner bindingsstedet, er vist i grøn for hydrofob, i lyseblå for polær og i mørkeblå for ladede rester. De interagerende rester αL242 og αL252 er ikke vist, fordi de er placeret under liganden. Hydrogenbindinger er angivet med stiplede og π-stabling interaktioner med solide sorte linjer. Røde prikker repræsenterer krystallografiske vandmolekyler. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202204052
Forskere ved Paul Scherrer Instituttet PSI og det italienske teknologiske institut IIT har udviklet et nyt stof, der inaktiverer et protein i celleskelettet, hvilket fører til celledød. På den måde kan stoffer af denne type forhindre fx vækst af tumorer. For at opnå dette kombinerede forskerne en strukturel biologisk metode med beregningsdesignet af aktive stoffer. Undersøgelsen blev vist i tidsskriftet Angewandte Chemie International Edition .
Celleskelettet, også kaldet cytoskelettet, gennemsyrer alle vores celler som et dynamisk netværk af trådlignende proteinstrukturer. Det giver celler deres form, hjælper med transporten af proteiner og større cellekomponenter og spiller en afgørende rolle i celledeling. Den centrale byggesten er proteinet tubulin. Det arrangerer sig selv i rørformede strukturer, mikrotubulus filamenter.
Aktive stoffer, der binder til celleskelettet, er blandt de mest effektive lægemidler mod kræft. De blokerer tubulin, og forhindrer dermed celledeling i tumorer. PSI-forskere har nu i samarbejde med det italienske teknologiske institut i Genova udviklet endnu et potent stof, der invaliderer tubulin. De har døbt det "Todalam."
"Todalam forhindrer tubulin i at arrangere sig i form af mikrotubuli-filamenter," forklarer førsteforfatter Tobias Mühlethaler, der var med til at designe og studere stoffet som en del af sin doktorgradsforskning ved PSI. "Proteinet forbliver som om det er frosset i en struktur, der ikke passer ind i mikrotubuli."
Rationelt designet
Der er typisk to forskellige tilgange til at udvikle nye lægemidler:Forskere kan teste et enormt antal molekyler for at fiske dem frem, der virker lovende, eller de kan specifikt designe kemiske molekyler, der opnår den ønskede effekt. PSI- og IIT-forskerne valgte den anden vej, som ofte er sværere.
Ved at gøre dette var de i stand til at bygge videre på deres eget grundlag, forskning, hvor de allerede havde lokaliseret steder i tubulin, hvor molekyler kan dock særligt godt. Det er de såkaldte bindingslommer, hvoraf de fandt 27. Derudover identificerede forskerne 56 fragmenter, der binder til disse steder. Dette værk var også blevet offentliggjort tidligere i Angewandte Chemie International Edition .
I den nuværende undersøgelse baseret på dette tidligere arbejde valgte forskerne i første omgang en nyopdaget bindingslomme på tubulin. De brugte beregningsdesign til at kombinere strukturerne af tre molekylære fragmenter, som fortrinsvis dokker på dette tidspunkt, til en enkelt kemisk forbindelse, og derefter syntetiserede de det i laboratoriet. "Ved at kombinere de tre fragmenter til ét molekyle håbede vi at forstærke effekten, da det nye molekyle fylder bindingslommen bedre," siger Michel Steinmetz, leder af Laboratory of Biomolecular Research ved PSI.
Ved hjælp af målinger ved Swiss Light Source SLS tjekkede forskerne for at se, hvor godt molekylet faktisk passer ind i bindingslommen. I yderligere to cyklusser forbedrede de stoffet, indtil de ankom til Todalam. "Med relativt simpel kemi lykkedes det os at nå frem til en potent forbindelse," siger Andrea Prota, en videnskabsmand i Steinmetz-gruppen, som samarbejdede tæt med Mühlethaler stolt.
Simpel kemisk struktur
I cellekulturer påviste forskerne, at Todalam dræber celler. Ikke så mærkeligt, da tubulin er afgørende for livet. "Jo bedre et stof binder sig til et kritisk sted i tubulin, jo mere giftigt er det for cellerne," forklarer Steinmetz. Det gør Todalam til et lovende udgangspunkt for at udvikle et lægemiddel.
De cytoskeletinhibitorer, der i øjeblikket er i klinisk brug, er naturlige stoffer med store, komplekse strukturer og er derfor svære at syntetisere. Den nyudviklede forbindelse Todalam kan derimod fremstilles i en simpel kemisk syntese i laboratoriet. "Det betyder også, at forbindelsen relativt let kunne fremstilles i store mængder," understreger Steinmetz. + Udforsk yderligere
Cellecytoskelet som mål for nye aktive stoffer
 Varme artikler
Varme artikler
-
 En ny strategi for grønnere anvendelse af calciumcarbidBorn-Oppenheimer molekylær dynamik af et acetylidmolekyle HO-Ca-CCH solvatiseret i DMSO. Kredit:Mikhail Polynski, assistentlærer ved Institute of Chemistry ved St Petersburg University Calciumacet
En ny strategi for grønnere anvendelse af calciumcarbidBorn-Oppenheimer molekylær dynamik af et acetylidmolekyle HO-Ca-CCH solvatiseret i DMSO. Kredit:Mikhail Polynski, assistentlærer ved Institute of Chemistry ved St Petersburg University Calciumacet -
 Ny metode tillader nem, alsidig syntese af lactonmolekylerKredit:CC0 Public Domain Kemikere ved Scripps Research har afsløret en metode til at omdanne billige og bredt tilgængelige kemikalier kendt som dicarboxylsyrer til potentielt meget værdifulde molek
Ny metode tillader nem, alsidig syntese af lactonmolekylerKredit:CC0 Public Domain Kemikere ved Scripps Research har afsløret en metode til at omdanne billige og bredt tilgængelige kemikalier kendt som dicarboxylsyrer til potentielt meget værdifulde molek -
 Opdagelse af helt ny klasse af RNA -hætter i bakterierGrafisk abstrakt. Kredit:Hudeček, O., Benoni, R., Reyes-Gutierrez, P.E. et al. Gruppen af Dr. Hana Cahová fra CAS, Institute of Organic Chemistry and Biochemistry, i samarbejde med forskere fra
Opdagelse af helt ny klasse af RNA -hætter i bakterierGrafisk abstrakt. Kredit:Hudeček, O., Benoni, R., Reyes-Gutierrez, P.E. et al. Gruppen af Dr. Hana Cahová fra CAS, Institute of Organic Chemistry and Biochemistry, i samarbejde med forskere fra -
 Sådan beregnes mængden af reaktant i ExcessOverskydende reaktant, også kendt som overskydende reagens, er den mængde kemisk, der er tilbage efter en afsluttet reaktion. Det styres af den anden reaktant, der bruges fuldstændigt og derfor ikke k
Sådan beregnes mængden af reaktant i ExcessOverskydende reaktant, også kendt som overskydende reagens, er den mængde kemisk, der er tilbage efter en afsluttet reaktion. Det styres af den anden reaktant, der bruges fuldstændigt og derfor ikke k
- Allerede dårligt stillet, Enlige forældre gik dramatisk tilbage under COVID
- Ekstra politibeføjelser under COVID-19 kan påvirke forholdet til offentligheden for altid
- Antarktis skjulte landskab formet af floder i varmere æra
- Jernselenid afsløret som have-varietet jernbaseret superleder
- Ny satellitteknologi tilbyder et mere detaljeret kort over antarktiske gletsjere i bevægelse
- Brug af sensorer til at forbedre interaktionen mellem mennesker og robotter, der går sammen


