Hvordan kan et molekyle vand ændre sig til noget helt andet?
1. Elektrolyse: Denne proces bruger elektricitet til at nedbryde vand i dets bestanddele, brint (H₂) og ilt (O₂).
2. Fotosyntese: Planter bruger sollys, vand og kuldioxid til at producere glukose (c₆h₁₂o₆) og ilt. Denne proces involverer nedbrydning af vandmolekyler og anvendelse af brintatomer til at danne glukose.
3. Forbrænding: Brændende brændstoffer som metan (CH₄) i nærvær af ilt producerer kuldioxid (CO₂) og vand. Denne proces involverer at kombinere iltatomer fra vandmolekyler med andre elementer for at danne nye molekyler.
4. Syre-base-reaktioner: Vand kan fungere som både en syre og en base. I reaktioner med syrer kan vand acceptere en proton (H+) til dannelse af hydroniumion (H₃O+). I reaktioner med baser kan vand donere en proton til dannelse af hydroxidionen (OH-).
5. Kemiske reaktioner: Vand kan deltage i utallige andre kemiske reaktioner som reaktant, produkt eller opløsningsmiddel. Disse reaktioner kan føre til dannelse af forskellige forbindelser, men de ændrer ikke grundlæggende vandets natur.
Vigtig note: Mens vand kan omdannes til andre stoffer gennem forskellige kemiske reaktioner, er de individuelle vandmolekyler i sig selv ikke "ødelagt." I stedet omarrangeres deres atomer for at danne nye molekyler.
I det væsentlige, mens et vandmolekyle kan være involveret i dannelse af forskellige forbindelser, forbliver dens grundlæggende sammensætning (to hydrogenatomer og et iltatom) den samme. For virkelig at ændre det til noget "helt andet", bliver du nødt til at nedbryde vandmolekylet i dets individuelle atomer og derefter bruge disse atomer til at danne helt nye stoffer.
Sidste artikelHvor er den genikulerede?
Næste artikelHvilken type atomer vises i en skeletmodel et organisk molekyle?
 Varme artikler
Varme artikler
-
 Forskere finder stor lineær negativ termisk ekspansion i intermetalliske Cr-Se-Te-forbindelserTemperaturafhængighed af volumenændringer af Cr-Te-Se med forskellige sammensætninger. Kredit:ZHENG Xinqi Forskere brugte et røntgendiffraktometer (XRD) med variabel temperatur på Kinas Steady Hig
Forskere finder stor lineær negativ termisk ekspansion i intermetalliske Cr-Se-Te-forbindelserTemperaturafhængighed af volumenændringer af Cr-Te-Se med forskellige sammensætninger. Kredit:ZHENG Xinqi Forskere brugte et røntgendiffraktometer (XRD) med variabel temperatur på Kinas Steady Hig -
 Elektroner øger faststof kaloriekøling i hexagonale sulfiderEt skitsekort for mekanismen for kæmpe barokalorisk (BC) effekt i Ni1-xFexS (op mønster). En sammenligning af volumennormaliseret entropiændring drevet af 100 MPa og termisk ledningsevne (k) for Ni 0
Elektroner øger faststof kaloriekøling i hexagonale sulfiderEt skitsekort for mekanismen for kæmpe barokalorisk (BC) effekt i Ni1-xFexS (op mønster). En sammenligning af volumennormaliseret entropiændring drevet af 100 MPa og termisk ledningsevne (k) for Ni 0 -
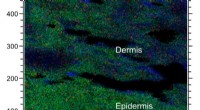 Ny metode kortlægger kemikalier i huden3-D billeddannelse af en hudsektion, hvor nikkelindholdet måles. Det røde område repræsenterer tilstedeværelsen af nikkel. Kredit:Per Malmberg En ny metode til at undersøge huden kan reducere an
Ny metode kortlægger kemikalier i huden3-D billeddannelse af en hudsektion, hvor nikkelindholdet måles. Det røde område repræsenterer tilstedeværelsen af nikkel. Kredit:Per Malmberg En ny metode til at undersøge huden kan reducere an -
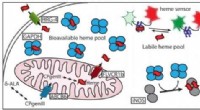 Hvordan celler håndterer en klæbrig, giftig, men absolut essentielt molekyleEt nyligt papir beskriver, hvordan hæm er chaperoneret til dets målproteiner. Kredit:Dennis Stuehr, Cleveland Clinic Nyder du at trække vejret? Du bør spare en tanke en gang imellem for heme, et j
Hvordan celler håndterer en klæbrig, giftig, men absolut essentielt molekyleEt nyligt papir beskriver, hvordan hæm er chaperoneret til dets målproteiner. Kredit:Dennis Stuehr, Cleveland Clinic Nyder du at trække vejret? Du bør spare en tanke en gang imellem for heme, et j
- Undersøgelser bekræfter, at stjernenovaer er den vigtigste kilde til lithium i universet
- Forskere bruger SLAC -instrument til at lære, hvad der sker med silicium under intenst pres
- Hvordan midnat graver i en hellig tibetansk hule åbnet vindue til forhistoriske mennesker, der bor …
- Hvorfor er jordskælv ofte forudgående vulkanudbrud.?
- Falske skælv:Anmeldelse af større californiske temblor en falsk alarm
- Hvordan kan du fremskynde kvaliteten på afstand?


