Hvor kalkvand tilberedes på laboratoriet?
Materialer:
* Calciumoxid (CAO) - QuickLime: Dette er den vigtigste ingrediens. Det er et hvidt, pulveriseret stof.
* destilleret vand: Brug destilleret vand for at undgå urenheder, der kan påvirke reaktionen.
* bægerglas: Til blanding og opbevaring af kalkvandet.
* tragt: Til filtrering af kalkvandet.
* filterpapir: Til adskillelse af uopløsede faste stoffer.
* omrøringsstang: Til blanding af løsningen.
Procedure:
1. sikkerhedsforholdsregler:
* Bær beskyttelsesbriller og handsker for at beskytte dine øjne og hud.
* Calciumoxid reagerer eksotermisk med vand og frigiver varme. Håndtere det med omhu.
* Arbejd i et godt ventileret område for at undgå at indånde støv.
2. Forbered kalkopløsningen:
* Tilsæt en lille mængde calciumoxid (QuickLime) i et rent bægerglas (quicklime) til destilleret vand.
* Start med en lille mængde quicklime (ca. 1-2 gram) og tilføjer gradvist mere om nødvendigt.
* Brug en lille mængde vand (ca. 50-100 ml) og omrør grundigt.
* Reaktionen producerer varme og får vandet til at blive overskyet.
* Fortsæt med at omrøre, indtil opløsningen bliver klar eller næsten klar.
3.. Filtrer løsningen:
* Brug en tragt foret med filterpapir til at filtrere opløsningen. Dette fjerner ethvert uopløst calciumoxid.
4. Opbevar kalkvandet:
* Opbevar det filtrerede kalkvand i en ren, lufttæt beholder.
* Mærk beholderen med datoen og "kalkvand."
Forklaring:
* Calciumoxid (CAO) reagerer med vand (H2O) for at danne calciumhydroxid (Ca (OH) 2), som er almindeligt kendt som kalkvand:
* CAO + H2O → CA (OH) 2
* Calciumhydroxid er en svag base. Det er en klar, farveløs løsning, der bliver mælkehvid, når den udsættes for kuldioxid i luften.
Nøglepunkter:
* kalkvand er ustabilt. Det vil absorbere kuldioxid fra luften og danne calciumcarbonat (CACO3) og dreje mælkeagtig.
* overskydende quicklime kan føre til et meget koncentreret kalkvand. Dette kan være skadeligt, hvis det indtages, eller hvis det kommer i kontakt med huden.
* Brug kalkvand frisk forberedt, når det er muligt.
Anvendelser af kalkvand i laboratoriet:
* test for kuldioxid (CO2): Kalkvand bliver mælkeagtig hvidt i nærvær af kuldioxidgas. Dette bruges i eksperimenter til at demonstrere produktionen af CO2.
* neutraliserende syrer: Kalkvand kan bruges til at neutralisere svage syrer.
* fremstiller andre calciumforbindelser: Kalkvand er et udgangsmateriale til fremstilling af andre calciumholdige forbindelser.
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelHvordan protoner i kernen tiltrækker elektroner.?
Næste artikelHvad er vigtige anvendelser af Bornite?
 Varme artikler
Varme artikler
-
 Afdækning af mikrogel-mysterierTC HS AFM-analyse af mikrogeler syntetiseret ved forskellige polymerisationsteknikker:(venstre) præcipitationspolymerisation, (i midten) invers miniemulsionspolymerisation under VPTT, og (højre) omven
Afdækning af mikrogel-mysterierTC HS AFM-analyse af mikrogeler syntetiseret ved forskellige polymerisationsteknikker:(venstre) præcipitationspolymerisation, (i midten) invers miniemulsionspolymerisation under VPTT, og (højre) omven -
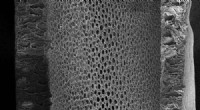 Membraner til industriel separering af kemiske blandingerEn overlegen membran, med en højere poretæthed, fremstilles ved syntetisering af denne polyacrylonitril -nanofiltreringsmembran ved hjælp af et ionisk flydende opløsningsmiddel. Kredit:© 2017 Susana N
Membraner til industriel separering af kemiske blandingerEn overlegen membran, med en højere poretæthed, fremstilles ved syntetisering af denne polyacrylonitril -nanofiltreringsmembran ved hjælp af et ionisk flydende opløsningsmiddel. Kredit:© 2017 Susana N -
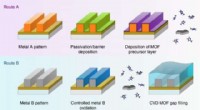 Ny isoleringsteknik baner vejen for kraftigere og mindre spånerFig. 1 Fra:Dampaflejrede zeolitiske imidazolat-rammer som huludfyldende ultra-lav-k-dielektrikum To foreslåede ruter til integration af ultra-lav-k MOF-dielektrik i on-chip-forbindelser via MOF-CVD-pr
Ny isoleringsteknik baner vejen for kraftigere og mindre spånerFig. 1 Fra:Dampaflejrede zeolitiske imidazolat-rammer som huludfyldende ultra-lav-k-dielektrikum To foreslåede ruter til integration af ultra-lav-k MOF-dielektrik i on-chip-forbindelser via MOF-CVD-pr -
 Effektivitetsspring ved adskillelse af para-xylen ved hjælp af nye kulstofmembranerGeorgia Tech brugte disse kulstofmembranmaterialer til at adskille para-xylen fra o-xylen. Kredit:Christopher Moore, Georgia Tech Benzinindustrien erkender vigtigheden af para-xylen, på grund af
Effektivitetsspring ved adskillelse af para-xylen ved hjælp af nye kulstofmembranerGeorgia Tech brugte disse kulstofmembranmaterialer til at adskille para-xylen fra o-xylen. Kredit:Christopher Moore, Georgia Tech Benzinindustrien erkender vigtigheden af para-xylen, på grund af
- Hvorfor kaldes kemiluminescens et koldt lys?
- Neutrinoraketmodel til at forklare oprindelsen af højhastighedspulsarer
- Hvordan satellitter, radarer og droner sporer meteoritter, der hjælper Jordens asteroideforsvar
- Hvor blev regionen kaldet Guale placeret?
- Forskere bygger en enzym-opdagende AI
- Hvorfor kaldes plasmamembranen semipermeabel membran?


