Når atomer kombineres, hvad får de eller taber de?
Her er en sammenbrud:
* At vinde elektroner: Ikke -metaller har en tendens til at få elektroner for at opnå en fuld ydre skal af elektroner og blive negativt ladede ioner kaldet anioner .
* taber elektroner: Metaller har en tendens til at miste elektroner for at opnå en fuld ydre skal og blive positivt ladede ioner kaldet kationer .
Disse modsatte ladede ioner tiltrækker derefter hinanden og danner en ionisk binding .
Eksempler:
* natrium (NA) , et metal, mister et elektron for at blive na⁺, en kation.
* klor (Cl) , en ikke -metal, får en elektron til at blive cl⁻, en anion.
* Disse modsatte ladede ioner tiltrækker derefter hinanden og danner den ioniske forbindelse natriumchlorid (NaCl) , almindeligt kendt som bordsalt.
Bemærk: Atomer kan også dele elektroner for at opnå stabilitet og danne en kovalent binding . Dette er almindeligt i ikke-metal-ikke-combinationer.
Sammenfattende får atomer eller mister elektroner for at opnå en mere stabil elektronkonfiguration, som er drivkraften bag kemisk binding.
Sidste artikelHvilke to klasser af materialer vil opløses i vand?
Næste artikelEr en blok af jernelementforbindelse eller blanding?
 Varme artikler
Varme artikler
-
 Forskere bruger RFID -chips til at spore biologiske prøverEn menneskelig leverorganoid med en indlejret RFID-mikrochip. Kredit:Kimura et al./iScience Radio frequency identification (RFID) chips bruges i dag til alt fra betaling for offentlig transport ti
Forskere bruger RFID -chips til at spore biologiske prøverEn menneskelig leverorganoid med en indlejret RFID-mikrochip. Kredit:Kimura et al./iScience Radio frequency identification (RFID) chips bruges i dag til alt fra betaling for offentlig transport ti -
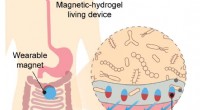 Levende sensorer undersøger tarmens mysterierSkematisk illustration af brugen af levende sensorer indkapslet i en magnetisk hydrogelanordning til undersøgelser af tarmen. Kredit:Xinyue Liu et al Forskning i den menneskelige tarm og mikrobe
Levende sensorer undersøger tarmens mysterierSkematisk illustration af brugen af levende sensorer indkapslet i en magnetisk hydrogelanordning til undersøgelser af tarmen. Kredit:Xinyue Liu et al Forskning i den menneskelige tarm og mikrobe -
 Video:Hvad er livet? Og vil vi finde det på andre planeter?Kredit:The American Chemical Society Kemi hjælper os med at finde ud af, hvordan livet kom i gang på Jorden og giver os molekyler at kigge efter på andre planeter. I denne episode af reaktioner, v
Video:Hvad er livet? Og vil vi finde det på andre planeter?Kredit:The American Chemical Society Kemi hjælper os med at finde ud af, hvordan livet kom i gang på Jorden og giver os molekyler at kigge efter på andre planeter. I denne episode af reaktioner, v -
 Oprettelse af mønstre spontant i syntetiske materialerEn polymerisationsfront markeret af varmegradienter (rød, højere temperatur) tillader spontan mønsterdannelse af polymerer med variable teksturer, farver og stivhed. Målestok, 1 cm. Kredit:Tilpasset f
Oprettelse af mønstre spontant i syntetiske materialerEn polymerisationsfront markeret af varmegradienter (rød, højere temperatur) tillader spontan mønsterdannelse af polymerer med variable teksturer, farver og stivhed. Målestok, 1 cm. Kredit:Tilpasset f
- Vedvarende opløsningsmidler afledt af lignin sænker spild i biobrændstofproduktion
- Hvordan astronauter arbejder
- Britiske lovgivere anbefaler skrappere regler på Facebook
- For at nå nettonul har verden stadig brug for minedrift. Efter 26 år, her er hvad jeg har lært om…
- Har modne røde blodlegemer kromosomer?
- Hvilke funktioner tjener skærme og ritualer på dyr?


