Hvilke to klasser af materialer vil opløses i vand?
1. ioniske forbindelser: Disse forbindelser består af positivt ladede ioner (kationer) og negativt ladede ioner (ANION) holdt sammen af elektrostatisk tiltrækning. Når disse forbindelser anbringes i vand, omgiver de polære vandmolekyler ionerne og trækker dem fra hinanden, bryder de ioniske bindinger og opløser forbindelsen. Eksempler inkluderer bordsalt (NaCl), kaliumchlorid (KCL) og natriumhydroxid (NaOH).
2. polære kovalente forbindelser: Disse forbindelser består af atomer, der deler elektroner ulige, hvilket skaber en adskillelse af ladning inden for molekylet. De polære vandmolekyler kan interagere med de ladede regioner i det polære molekyle, trække det fra hinanden og opløse det. Eksempler inkluderer sukker (saccharose), ethanol og eddikesyre.
Det er vigtigt at bemærke, at nogle materialer, som olie, er ikke -polære og ikke opløses i vand. Dette skyldes, at vandmolekylerne ikke kan interagere med de ikke -polære molekyler effektivt.
 Varme artikler
Varme artikler
-
 Polymeriseringsproces af hydrogelmikrosfærer på videoStrukturel udvikling. Kredit:Genoptrykt med tilladelse fra Langmuir 2021, 37, 151-159. Copyright (2021) American Chemical Society Vandig fri-radikal udfældningspolymerisering er en af de mest ny
Polymeriseringsproces af hydrogelmikrosfærer på videoStrukturel udvikling. Kredit:Genoptrykt med tilladelse fra Langmuir 2021, 37, 151-159. Copyright (2021) American Chemical Society Vandig fri-radikal udfældningspolymerisering er en af de mest ny -
 Biokemiske netværk kortlagt i mellemtarmen af Aedes aegypti-mygAdjunkt Rushika Perera og kandidatstuderende Rebekah Gullberg på arbejde på Laboratoriet for leddyrbårne og infektionssygdomme. Kredit:William A. Cotton/Colorado State University Photography I løb
Biokemiske netværk kortlagt i mellemtarmen af Aedes aegypti-mygAdjunkt Rushika Perera og kandidatstuderende Rebekah Gullberg på arbejde på Laboratoriet for leddyrbårne og infektionssygdomme. Kredit:William A. Cotton/Colorado State University Photography I løb -
 Mikrobielt tyveri muliggør nedbrydning af metan, giftig methylkviksølvForskere fik ny indsigt i de mekanismer, som nogle methan-fødende bakterier kaldet metanotrofer bruger til at nedbryde toksinet methylkviksølv. Kredit:Andy Sproles/ORNL, US Department of Energy; Jerem
Mikrobielt tyveri muliggør nedbrydning af metan, giftig methylkviksølvForskere fik ny indsigt i de mekanismer, som nogle methan-fødende bakterier kaldet metanotrofer bruger til at nedbryde toksinet methylkviksølv. Kredit:Andy Sproles/ORNL, US Department of Energy; Jerem -
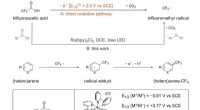 Trifluoreddikesyre virker som trifluormethyleringsmiddel i aren CH-funktionaliseringTrifluormethylering, Chlorodifluormethylering og Perfluoralkylering af Arenes. Kredit:JIN Jian Forskere ved Shanghai Institute of Organic Chemistry fra det kinesiske videnskabsakademi har udviklet
Trifluoreddikesyre virker som trifluormethyleringsmiddel i aren CH-funktionaliseringTrifluormethylering, Chlorodifluormethylering og Perfluoralkylering af Arenes. Kredit:JIN Jian Forskere ved Shanghai Institute of Organic Chemistry fra det kinesiske videnskabsakademi har udviklet
- Svedende for et køligere Singapore
- Leder en golfbold energi?
- Tarmens evolutionære oprindelse
- Kogende gennembrud:Nanocoating fordobler varmeoverførselshastigheden
- En tilgang til at fremstille stabile perovskite kvanteprik-solceller med høj effektkonverteringseff…
- Hvilket økosystem har frugtbar jord dækket med højt græs?


