Hvad er kogepunktet med 1 molær glukoseopløsning?
* kogepunkthøjde: Opløsning af et opløst stof (som glukose) i et opløsningsmiddel (som vand) hæver opløsningens kogepunkt sammenlignet med det rene opløsningsmiddel. Dette kaldes kogepunkthøjde.
* Effekten af koncentration: Omfanget af kogepunkthøjde afhænger af koncentrationen af opløstelsen. En højere koncentration betyder en større stigning i kogepunkt.
* Behovet for den ebullioscopic -konstant: For at beregne den nøjagtige kogepunkthøjde har du brug for den ebullioscopic -konstant (KB) af opløsningsmidlet. Den ebullioscopic -konstant er en specifik egenskab ved opløsningsmidlet og afspejler, hvor let dens kogepunkt ændrer sig med tilsætning af opløste stoffer.
Her er den grundlæggende formel til at beregne kogepunkthøjden (ΔTB):
Δtb =kb * m * i
hvor:
* ΔTB =kogepunkthøjde
* KB =Ebullioscopic Constant of the Solvent (for vand, KB =0,512 ° C/molal)
* m =molalitet af opløsningen (mol opløst stof pr. Kg opløsningsmiddel)
* i =Van't Hoff Factor (tegner sig for antallet af partikler Solute dissocieres i i opløsning - glukose adskiller sig ikke, så i =1)
For at beregne kogepunktet for den 1 molære glukoseopløsning skal du:
1. Konverter molariteten til molalitet: Du skal kende densiteten af løsningen for at gøre dette.
2. Brug formlen ovenfor til at beregne Δtb.
3.
Lad mig vide, om du har densiteten af glukoseopløsningen, og jeg kan hjælpe dig med at beregne kogepunktet.
 Varme artikler
Varme artikler
-
 Noget ondt (lugtende) på denne måde kommer - videnskaben om stoffer og lugteTobi Richter og professor Raechel Laing. Kredit Sharron Bennett Forskere fra New Zealands universitet i Otago har brugt avanceret teknologi til at finde ud af, hvorfor tre almindelige fibertyper e
Noget ondt (lugtende) på denne måde kommer - videnskaben om stoffer og lugteTobi Richter og professor Raechel Laing. Kredit Sharron Bennett Forskere fra New Zealands universitet i Otago har brugt avanceret teknologi til at finde ud af, hvorfor tre almindelige fibertyper e -
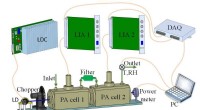 Ny sensor til måling af atmosfæriske aerosoler og nitrogendioxid samtidigtEksperimentel opsætning af D-PAS. Kredit:LIU Kun For nylig, Prof. 2 ) samtidigt. Atmosfæriske aerosoler og NO 2 betragtes som de vigtigste forurenende stoffer i luften, mens online måling af
Ny sensor til måling af atmosfæriske aerosoler og nitrogendioxid samtidigtEksperimentel opsætning af D-PAS. Kredit:LIU Kun For nylig, Prof. 2 ) samtidigt. Atmosfæriske aerosoler og NO 2 betragtes som de vigtigste forurenende stoffer i luften, mens online måling af -
 Biologisk inspireret membran renser kulfyret røg for drivhusgasserSandia National Laboratories-stipendiat og University of New Mexico-regentprofessor Jeff Brinker ledede arbejdet med at udvikle det billige memzyme, der er i stand til at fjerne kulrøg for kuldioxid,
Biologisk inspireret membran renser kulfyret røg for drivhusgasserSandia National Laboratories-stipendiat og University of New Mexico-regentprofessor Jeff Brinker ledede arbejdet med at udvikle det billige memzyme, der er i stand til at fjerne kulrøg for kuldioxid, -
 En squishy Rubiks Cube, som kemikere bygget af polymerer holder løfte om datalagringEn ny Rubiks Cube-lignende struktur lavet af en selvhelbredende hydrogel kan måske inspirere til nye måder at opbevare information på og muligvis hjælpe patienter med at overvåge deres medicinske tils
En squishy Rubiks Cube, som kemikere bygget af polymerer holder løfte om datalagringEn ny Rubiks Cube-lignende struktur lavet af en selvhelbredende hydrogel kan måske inspirere til nye måder at opbevare information på og muligvis hjælpe patienter med at overvåge deres medicinske tils
- Hvordan vores encellede slægtninge pakker deres DNA
- Hvordan Miamis Amazon-forhandlerhær betjener kunder over hele verden – og tjener millioner
- Er klor og natrium en forbindelse?
- Uddybende spørgsmål:Er kunstnere født eller undervist?
- Ny undersøgelse viser, at furfuralderivater er en måde at gøre produktion af vedvarende brændsto…
- Hvordan molekylære riboswitches virker i bakterier


