Fungerer temperaturen som en katalysator?
* katalysatorer Lavere aktiveringsenergi: Katalysatorer fremskynder kemiske reaktioner ved at tilvejebringe en alternativ reaktionsvej med en lavere aktiveringsenergi. De forbruges ikke i reaktionen og kan bruges gentagne gange.
* Temperatur øger reaktionshastigheden: Temperaturen øger molekylernes kinetiske energi, hvilket fører til hyppigere kollisioner og en større sandsynlighed for vellykkede reaktioner. Imidlertid giver temperaturen ikke en ny reaktionsvej.
Tænk på det sådan:
* katalysator: Forestil dig en tunnel gennem et bjerg. Det gør det lettere at komme til den anden side, men det er stadig den samme rejse.
* Temperatur: Forestil dig at øge hastigheden på bilerne, der går over bjerget. Dette får dem til at nå den anden side hurtigere, men de er stadig nødt til at gå over bjerget.
Temperatur kan imidlertid være en afgørende faktor i kemiske reaktioner:
* optimal temperatur: Hver reaktion har en optimal temperatur, hvor hastigheden maksimeres. Under denne temperatur er reaktionen langsom, og over den kan molekylerne gå i stykker.
* Aktiveringsenergi: Temperaturen er direkte relateret til den aktiveringsenergi, der kræves for at en reaktion kan forekomme. Højere temperaturer giver mere energi, hvilket gør det lettere at overvinde aktiveringsenergibarrieren.
Kortfattet:
* Temperatur øger reaktionshastigheden, men er ikke en katalysator.
* katalysatorer giver en ny reaktionsvej, mens temperaturen påvirker hastigheden på den eksisterende vej.
Fortæl mig, hvis du har andre spørgsmål!
 Varme artikler
Varme artikler
-
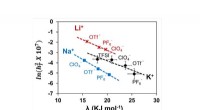 Ikke mere trial-and-error, når du vælger en elektrolyt til metal-luft-batterierDenne graf viser korrelationerne mellem tre parametre, der fører til en enkelt deskriptor, som giver et rationelt grundlag for at designe elektrolytsammensætninger til højeffekt alkalimetal-ilt-batter
Ikke mere trial-and-error, når du vælger en elektrolyt til metal-luft-batterierDenne graf viser korrelationerne mellem tre parametre, der fører til en enkelt deskriptor, som giver et rationelt grundlag for at designe elektrolytsammensætninger til højeffekt alkalimetal-ilt-batter -
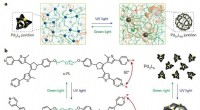 Lysstyrede polymerer kan skifte mellem robuste og blødeDesign af polyMOCer med fotoskiftbar topologi. Kredit:(c) Natur (2018). DOI:10.1038/s41586-018-0339-0 MIT -forskere har designet et polymermateriale, der kan ændre dets struktur som reaktion på
Lysstyrede polymerer kan skifte mellem robuste og blødeDesign af polyMOCer med fotoskiftbar topologi. Kredit:(c) Natur (2018). DOI:10.1038/s41586-018-0339-0 MIT -forskere har designet et polymermateriale, der kan ændre dets struktur som reaktion på -
 Labfremstillede proteinkugle co-faktor som en stor ol gatorDet syntetiske protein klemmer sig fast på porphyrinen som en alligators kæber. Kredit:Nicholas Polizzi Proteiner har magt til at turbolade biokemiske reaktioner inde i kroppen. Uden hjælp af pro
Labfremstillede proteinkugle co-faktor som en stor ol gatorDet syntetiske protein klemmer sig fast på porphyrinen som en alligators kæber. Kredit:Nicholas Polizzi Proteiner har magt til at turbolade biokemiske reaktioner inde i kroppen. Uden hjælp af pro -
 Affaldsplast, der omdannes til filtreringsmembranerBruno Pulido tester effektiviteten af holdets syntetiske membran. Kredit:KAUST I en verden, der synes at drukne i plastflasker, genanvendelse af dette affald til nyttige materialer ville bidrage
Affaldsplast, der omdannes til filtreringsmembranerBruno Pulido tester effektiviteten af holdets syntetiske membran. Kredit:KAUST I en verden, der synes at drukne i plastflasker, genanvendelse af dette affald til nyttige materialer ville bidrage
- Kan vi droppe mørk energi ved bedre at forstå den generelle relativitetsteori?
- Modellering af terroristadfærd med Sandia social-kulturelle vurderinger
- Hvad er vejen for flowelektricitet?
- Løsning på problemet med asiatisk karpe:spise dem?
- Forskere opdager, hvordan vand bliver regenereret på asteroider
- Hvad er bølgelængden, der har en frekvens på 100 Hz?


